PNAS:溶酶体介导的细胞死亡表观转录调控新分子和通路研究获进展
时间:2022-02-09 11:18:58 热度:37.1℃ 作者:网络
溶酶体膜的完整性对细胞的命运十分重要,一旦溶酶体膜通透性改变,就会释放以组织蛋白酶为主的多种水解酶到细胞质中,通常导致细胞死亡,即溶酶体依赖性细胞死亡。目前,存在多种机制可解释溶酶体通透性。鉴于溶酶体功能在癌细胞中的重要作用,已有科研人员针对溶酶体开发了多种小分子化合物,其可诱导溶酶体膜通透性或者干预溶酶体功能来杀伤肿瘤细胞。例如,氯喹可诱导溶酶体膜通透性来调节溶酶体功能,从而恢复难治性非小细胞肺癌细胞对顺铂的敏感性;沙利霉素有效隔离溶酶体内的铁诱导溶酶体膜通透性,从而有效杀死肿瘤细胞。
上述发现表明,对传统疗法不敏感的癌细胞或可通过使用激活溶酶体细胞死亡途径进行有效治疗。此外,肿瘤细胞溶酶体比正常细胞更脆弱并且更容易发生溶酶体膜通透性和溶酶体依赖性细胞死亡。因此,针对溶酶体依赖性细胞死亡途径的干预可能是多种类型癌症的有效治疗策略。然而,目前关于溶酶体依赖细胞死亡的认识不足,相关的分子靶标及分子机制有待深入研究。
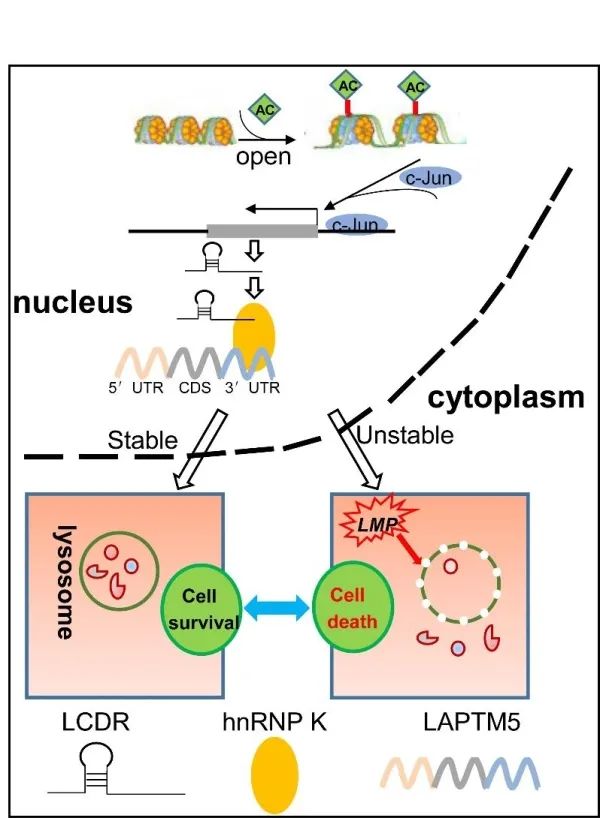
LCDR/hnRNP K/LAPTM5调控模式图
近日,中国科学院苏州生物医学工程技术研究所生物标志物研究中心科研人员在Proceedings of the National Academy of Sciences上发表了题为LCDR regulates the integrity of lysosomal membrane by hnRNP K-stabilized LAPTM5 transcript and promotes cell survival的研究论文。该研究首次报道了调控溶酶体介导细胞死亡的表观转录调控新分子,并阐明了调控机制以及临床意义,为肿瘤生物标志物的开发与临床靶向治疗提供了新的理论基础。
研究者系统性整合分析了组蛋白乙酰化调控以及癌症基因组图谱数据库差异表达的基因,发现一个全新的溶酶体细胞死亡调节(lysosome cell death regulator, LCDR)基因在肺癌中显著高表达且受到组蛋白乙酰化的调控。为研究LCDR的生物学功能,研究者在肺癌细胞中敲减LCDR进行实验,敲减LCDR显著降低细胞的增殖以及克隆形成能力,并诱导了细胞凋亡。同样地,小鼠皮下移植瘤实验显示出一致的结果。
为进一步阐明LCDR调控的信号通路,研究者通过RNA下拉、转录组测序及RNA结合蛋白免疫沉淀等实验证实,LCDR通过与核内不均一核糖核蛋白K(heterogeneous nuclear ribonucleoprotein k, hnRNP K)的KH1结构域相互结合,促进hnRNP K蛋白的KH3结构域与溶酶体跨膜蛋白5( lysosomal protein transmembrane 5, LAPTM5)的3′末端非翻译区相互结合,并提高了LAPTM5的稳定性,维持了溶酶体膜的稳定性,从而抑制溶酶体依赖性细胞死亡,促进细胞生存。
组蛋白乙酰化修饰是表观遗传的重要调控方式,其复杂而精准地调控基因表达,在肿瘤的发生与发展过程中发挥重要作用。靶向组蛋白去乙酰化酶是癌症治疗中具有前景的治疗策略,然而,临床前证据表明,靶向组蛋白去乙酰化酶的单一药物在癌症患者治疗中仅具有中等疗效,这可能是由于靶向组蛋白去乙酰化酶药物同时影响了二级信号通路。该研究中,研究者系统性鉴定了组蛋白乙酰化调控的基因表达谱,并发现组蛋白去乙酰化酶抑制剂可以显著诱导LCDR的表达并通过维持溶酶体的完整性促进癌细胞存活,这可能是导致乙酰化酶药物不良效果的部分原因。因此靶向组蛋白去乙酰化酶和LCDR的联合治疗可能对部分患者疗效更佳,为患者治疗提供了新思路。
研究还表明,LCDR,hnRNPK和LAPTM5的表达量显著高于癌旁组织,LCDR与hnRNP K以及LAPTM5的表达量存在显著相关性,且LCDR/hnRNP K/LAPTM5受试者工作曲线联合分析显示出更高的灵敏度以及特异性。此外,研究者开发了核靶向性的纳米材料递送si-LCDR,并使用患者来源异种移植小鼠模型鉴定了LCDR作为临床靶标的可行性。
综上,研究者首次鉴定出一个全新的表观转录调控新分子在转录后水平调控溶酶体依赖性细胞死亡(如图),并揭示了全新的LCDR/hnRNP K/LAPTM5轴调控肺癌的发生与发展,为癌症治疗提供了具有前景的策略。研究工作得到国家自然科学基金、中科院战略性先导科技专项等的支持。


