Nature/EMBO J :武汉大学宋保亮团队发现胆固醇修饰SMO对Hh信号通路的激活至关重要
时间:2022-12-26 15:00:29 热度:37.1℃ 作者:网络
Hedgehog (Hh)信号通路在胚胎发育中起着关键作用。Hh结合到Patched1 (PTCH1)抑制Smoothened (SMO),从而激活下游信号转导。胆固醇对SMO富半胱氨酸结构域(CRD)的共价修饰对SMO的功能至关重要。SMO的胆固醇化是一种钙加速的自加工反应,STIM-ORAI介导的储存操作钙进入促进胆固醇化和核内体定位的SMO的激活。然而,目前尚不清楚Hh-PTCH1的相互作用是否调控内质网(ER)定位的SMO的活性。
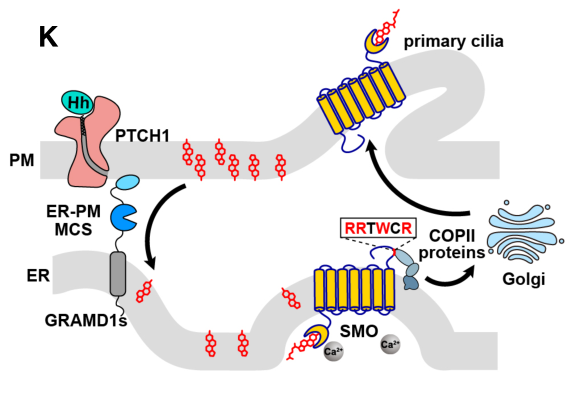
2022年12月16日,武汉大学宋保亮团队在 EMBO Journal(IF=14)在线发表题为“GRAMD1/ASTER-mediated cholesterol transport promotes Smoothened cholesterylation at the endoplasmic reticulum”的研究论文,该研究表明GRAMD1/ASTER 介导的胆固醇转运促进内质网SMO胆固醇化。该研究发现PTCH1抑制了来自ER的依赖于COPII的SMO输出,而Hh促进了这一过程。
SMO胞浆尾部的RRxWxR氨基酸基对COPII识别、纤毛定位和信号转导活性至关重要。Hh和PTCH1调节ER定位的SMO的胆固醇修饰,而SMO的胆固醇化加速了它从ER的退出。GRAMD1/ASTER固醇转运蛋白促进胆固醇从PM转移到ER,导致SMO胆固醇化增加和Hh信号增强。总之,作者揭示了GRAMD介导的胆固醇转运在ER驻留SMO成熟和Hh信号通路中的调节作用。
另外,2022年8月3日,武汉大学宋保亮团队在Nature 在线发表题为“Inhibition of ASGR1 decreases lipid levels by promoting cholesterol excretion”的研究论文,该研究表明靶向ASGR1可上调LXRα、ABCA1和ABCG5/G8,抑制SREBP1和脂肪生成,从而促进胆固醇排泄并降低血脂水平。