Cell Res:清华大学俞立团队揭示基于迁移体的新型细胞分泌模式
时间:2024-07-02 16:02:16 热度:37.1℃ 作者:网络
迁移体(Migrasomes)富含趋化因子、细胞因子和血管生成因子等信号分子,在这些分子的空间传递中起着关键作用,影响器官形态发生和血管生成等关键生理过程。调控迁移体中信号分子积累的机制一直是难以捉摸的。
2024年6月25日,清华大学俞立团队在Cell Research 在线发表题为“Localized, highly efficient secretion of signaling proteins by migrasomes”的研究论文,该研究发现分泌蛋白,包括信号蛋白,通过分泌载体通过组成和调节的分泌途径转运到迁移体中。在细胞迁移过程中,这些载体的很大一部分被重定向到细胞后部,并在肌动蛋白依赖的运动蛋白Myosin-5a的驱动下主动运输到迁移小体中。
一旦到达迁移体,这些载体通过SNARE介导的机制与迁移体膜融合。抑制迁移体的形成可显著减少分泌,提示迁移体是迁移细胞的主要分泌途径。总之,该研究的发现揭示了迁移细胞中一种特殊的、高度局部化的分泌模式,在概念上与神经元系统中观察到的靶向神经递质释放平行。

迁移体是最近在迁移细胞中发现的细胞器,形成于收缩纤维上,收缩纤维是存在于细胞后缘的细长膜系索。这些迁移体的特点是其大的囊泡结构,平均直径约为2µm,以容纳许多腔内囊泡而闻名,其起源在很大程度上尚不清楚。迁移体在将信号分子(包括趋化因子和细胞因子)定向递送到精确位置方面发挥着重要作用,从而对需要整合空间和化学信息的生理过程产生重大影响。一个突出的例子是在斑马鱼胚胎发育的原肠胚期,由中胚层细胞形成的迁移体富含趋化因子和生长因子等信号配体,对器官形态发生过程有重要贡献。然而,迁移体选择性运输和随后释放这些信号配体的确切机制仍有待完全阐明。
细胞分泌是一个基本的生物学过程,分泌蛋白是由信号肽引导到内质网的。在转运进入内质网腔后,信号肽被切割,这些蛋白质通过COPII包被的囊泡被运送到高尔基体复合体。在高尔基体中,它们经过进一步的翻译后修饰,然后通过构成或调节的分泌途径释放。特别是,受调节的途径需要颗粒或细胞器中间体来分泌,并被特定的细胞信号激活。在这种情况下,循环内体,尤其是富含VAMP3的管状突起,对于某些Rab GTPases(如Rab11)调节分泌物(如TNF)向质膜的靶向递送至关重要。相反,Rab8通常与组成性分泌途径相关。
运动蛋白,包括运动蛋白、动力蛋白和肌球蛋白,在分泌囊泡的细胞内运输中起关键作用。这些蛋白穿过细胞骨架网络,运动蛋白和动力蛋白促进沿着微管的远程运输,而肌凝蛋白,特别是肌凝蛋白5a,协调沿着肌动蛋白丝的囊泡的短程运动。这对于分泌的最后步骤至关重要,包括囊泡对接和与质膜融合。分泌载体与质膜的最终融合由Q-SNAREs介导,如SNAP,和R-SNAREs介导,如VAMP2和VAMP3,它们已成为分泌载体的有用标记。各种研究表明,SNARE蛋白的水平是细胞因子分泌的限速步骤。分泌效率和分泌量受细胞膜上SNARE蛋白水平的调节;因此,SNARE蛋白的膜密度决定了其分泌的倾向。
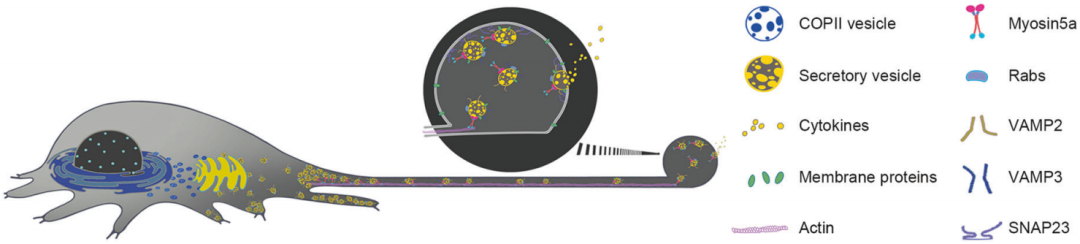
文章模式图(图源自Cell Research )
高度局部分泌在神经元中有充分的证据。在这些细胞中,含有神经递质的突触囊泡在运动蛋白的驱动下通过轴突运输被运送到轴突终末。到达后,囊泡准备释放,等待动作电位触发轴突末端的神经递质释放,这是突触传递的关键步骤。其他类型的细胞在多大程度上表现出类似的特殊分泌机制仍然是一个悬而未决的问题。除轴突末端外,这种过程在特殊细胞结构中的发生尚不清楚。
该研究证明了分泌蛋白,包括信号蛋白,通过分泌载体从组成和调节的分泌途径转运到迁移体中。该研究发现,在细胞迁移过程中,这些载体中的很大一部分被重定向到细胞后部,并主动运输到迁移体中。这个过程是由肌动蛋白依赖的运动蛋白Myosin-5a驱动的。此外,该研究发现这些载体通过SNARE介导的机制与迁移体膜融合。值得注意的是,该研究还表明,抑制迁移体的形成会显著减少分泌,这表明迁移体是迁移细胞的主要分泌途径。在这些数据的基础上,该研究提出了一种以前未知的迁移细胞分泌模式,类似于突触囊泡释放。
参考消息:
https://www.nature.com/articles/s41422-024-00992-7


