Nature子刊:浙江大学林世贤团队发现了一种新的蛋白质翻译后修饰
时间:2023-01-06 12:02:18 热度:37.1℃ 作者:网络
蛋白质翻译后修饰(PTM)几乎调节真核生物细胞过程的各个方面。然而,新的蛋白PTMs的鉴定是非常具有挑战性的。
2023年1月2日,浙江大学林世贤团队在Nature Structural & Molecular Biology(IF=18)在线发表题为“Genetic code expansion reveals aminoacylated lysine ubiquitination mediated by UBE2W”的研究论文,该研究表明遗传密码扩增揭示了由UBE2W介导的氨基化赖氨酸泛素化。该研究使用遗传编码的非天然氨基酸作为化学探针,报告了一种以前未报道的蛋白PTM形式的鉴定和验证,氨基酰化赖氨酸泛素化,其中修饰发生在氨基酰化赖氨酸的α-胺基上。
该研究在两个人类细胞系的全部20个氨基酰化赖氨酸上鉴定出超过2000个泛素化位点。这些修饰可以介导快速的蛋白质降解,补充典型赖氨酸泛素化介导的蛋白质组降解。此外,该研究证明了泛素偶联酶UBE2W作为氨基酰化赖氨酸泛素化的“书写者”,促进了蛋白质上的泛素化事件。更广泛地说,氨基酰化赖氨酸泛素化的发现和验证,为利用遗传密码扩增策略鉴定和验证新的蛋白PTMs奠定了基础。

蛋白质可以通过多种化学功能的共价添加进行翻译后修饰,如乙酰化、甲基化、磷酸化、糖基化、脂化和泛素化。这些蛋白质的化学修饰显著增加了蛋白质组的功能多样性,并几乎调节细胞过程的各个方面。因此,新的蛋白质翻译后修饰(PTMs)的鉴定在化学和生物学上都非常重要。然而,鉴定过程非常具有挑战性,主要是由于缺乏这些未知修饰及其富集方法的化学信息。
最近,赖氨酸氨基酰化被确定为蛋白质的可逆PTM,其中赖氨酸的ε-胺基与20种天然氨基酸中的任何一种的α-羧基(COOH)共价连接。这种类型的PTM将赖氨酸的ε-胺基转化为相连氨基酸的α-胺基,从而容易发生进一步的PTM。α-胺基仅存在于新生蛋白的N端,可被翻译后修饰或共修饰,在蛋白质合成、稳定性、定位和功能等多个过程中发挥重要作用。相反,内α-胺对氨基酰化赖氨酸残基的修饰完全未知。
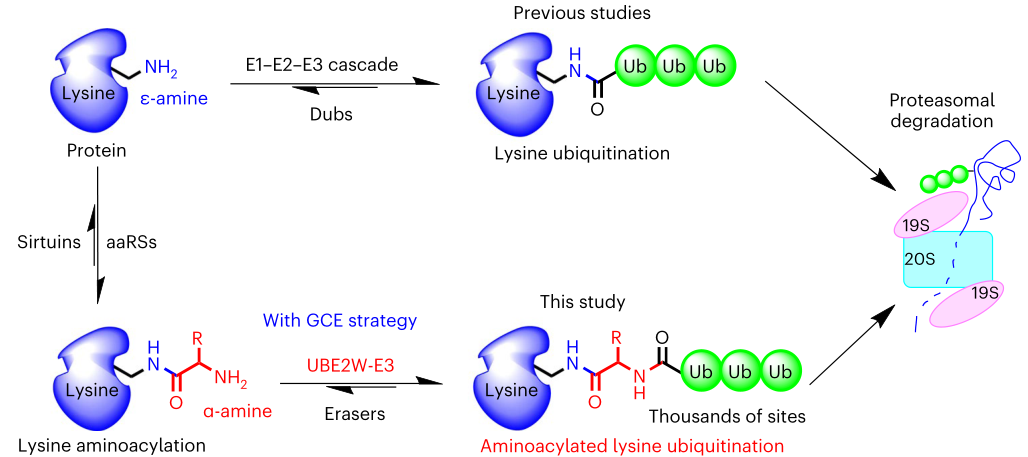
氨基酰化赖氨酸泛素化(Ub)(图源自Nature Structural & Molecular Biology )
此外,赖氨酸氨基酰基化研究在技术上具有传统生物化学和遗传学方法的挑战性,因为20种赖氨酸氨基酰基化之间的化学相似性及其相应的作者氨酰基-trna合成酶的重要性。因此,作者试图通过使用遗传密码扩增(GCE)策略,以非天然氨基酸(UAAs)的形式特异性结合赖氨酸氨基酰化探针来研究赖氨酸氨基酰化的修饰和功能。
该研究应用GCE策略,报告了新形式的蛋白质PTM的成功鉴定和生化验证,即氨基酰化赖氨酸泛素化(或K-XUb)以及编写酶UBE2W,其在内部α胺基团上显示出意想不到的酶活性。
原文链接:
https://www.nature.com/articles/s41594-022-00866-9


