FDA 咨询委员会建议批准抗真菌新药rezafungin(瑞扎芬净)上市,为10多年来首款
时间:2023-01-28 06:02:07 热度:37.1℃ 作者:网络
2023年1月25日,FDA 抗菌药物咨询委员会以14:1 赞成批准抗真菌新药rezafungin(瑞扎芬净)上市,用于治疗念珠菌血症和侵袭性念珠菌病。该药由Cidara 和Melinta Therapeutics, LLC研发,为近十多年来首款抗真菌类药物。

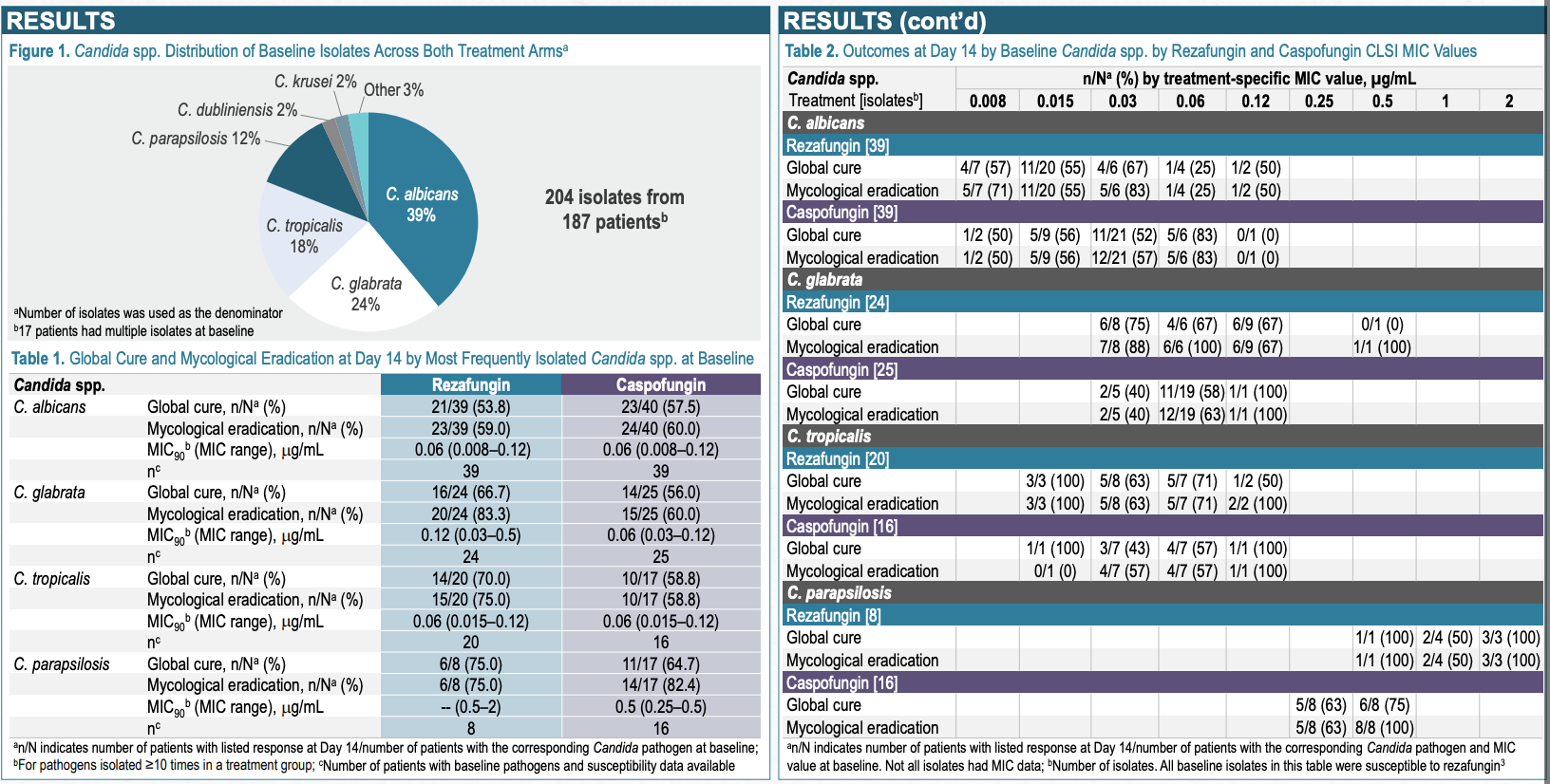
委员会的投票是基于Cidara的全球ReSTORE 3期临床数据(ClinicalTrials.gov: NCT03667690), 和STRIVE 2期临床试验 (ClinicalTrials.gov: NCT02734862)。Rezafungin每周给药一次,与目前每天给药一次的标准疗法caspofungin相比,具有非劣效性,达到FDA和EMA的主要终点标准。
同时,rezafungin 的安全性与 FDA 批准的其他棘白菌素相似。 在非临床和临床研究中确定了神经毒性安全信号。
rezafungin是一种新型的,一周一次的棘球白素,其结构和特性经过改进,保留了棘球白素类药物的安全优势,同时增强了其药代动力学和药效学特性,开发了一种更持久的下一代治疗和预防药物。
在美国,rezafungin已获得合格传染病产品资格(QIDP)、快速通道资格和孤儿药资格。FDA决定的PDUFA日期为2023年3月22日。详细见:侵入性念珠菌病的治疗,Rezafungin获“孤儿药资格”
EMA于2022年8月接受了rezafungin的上市许可申请(MAA),目前正在审查中。
Cidara总裁兼首席执行官Jeffrey Stein表示:"我们非常高兴FDA咨询委员会建议FDA批准rezafungin用于治疗念珠菌血症和侵袭性念珠菌病。这一积极的建议是为侵袭性念珠菌感染患者提供每周一次的治疗目标迈出的重要一步,因为十多年来没有新药获得批准。"
参考资料:
- US Food and Drug Administration. Rezafungin for Injection. FDA Briefing Document. January 24, 2023. https://www.fda.gov/media/164666/download.
- https://www.fda.gov/media/164666/download


