ACS Nano:基于纳米平台的糖尿病肾病的多靶点治疗研究
时间:2023-09-23 23:10:48 热度:37.1℃ 作者:网络
糖尿病肾病是糖尿病最常见的慢性并发症之一,目前已成为终末期肾脏病的主要原因。目前糖尿病肾病的治疗主要采用积极控制血糖、RAASi控制血压及蛋白尿等措施,虽可一定程度缓解病情,但仍有近30%~40%的患者进展到终末期肾病,给社会及家庭带来沉重的负担。因此,探索新的糖尿病肾病的治疗策略具有重要的临床价值。既往的研究显示mTOR抑制剂等在动物实验中表现出良好的延缓糖尿病肾病进展的作用,但在临床实验中,因其严重的全身不良反应限制其在临床中的应用。如何有效的将这类药物应用于糖尿病肾病治疗中,并避免其全身不良反应,成为糖尿病肾病药物研发的巨大挑战。
近期,重庆医科大学附属第二医院钟玲教授团队,通过开发一种纳米平台(ESC-HCM-B)将多种药物定点靶向递送至肾脏足细胞,以实现糖尿病肾脏病的肾脏靶向治疗。该技术有效的克服该类药物的全身不良反应,实现肾脏的精准靶向给药,并针对糖尿病肾病异质性特点,将纳米平台多功能化修饰,实现了糖尿病肾病的多靶点治疗。相关工作以“Enhanced bio-homogeneous composite membrane-encapsulated nano-platform with podocyte targeting for precise and safe treatment of diabetic nephropathy”为题发表在ACS Nano。

在这项研究中,巨大的挑战为纳米平台如何高效特异地穿透肾小球滤过屏障以靶向足细胞,而又不随尿液排出。纳米平台以介孔二氧化硅纳米为核心载体(20-40 nm),其表面化学共轭配体BMS-470539,选择性结合并激动足细胞黑素皮质素1型受体(MC-1R),这样纳米平台有效的精准靶向足细胞并激活G蛋白偶联受体,通过cAMP-PKA通路途径发挥抗炎作用。其次:为防止纳米平台到达足细胞靶前被单核-巨噬系统清除,而导致溶血及药物过早释放,采用同源红细胞膜并加以生物强化改造,便有效避免了非靶向清除,极大程度地提高纳米平台的生物相容性及稳定性。
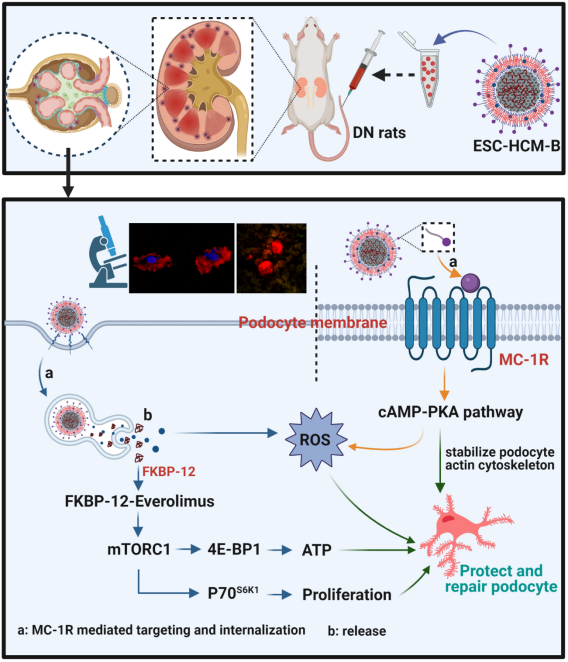
图1. ESC-HCM-B通过延缓肾小球纤维化和改善能量代谢治疗糖尿病肾病的机制
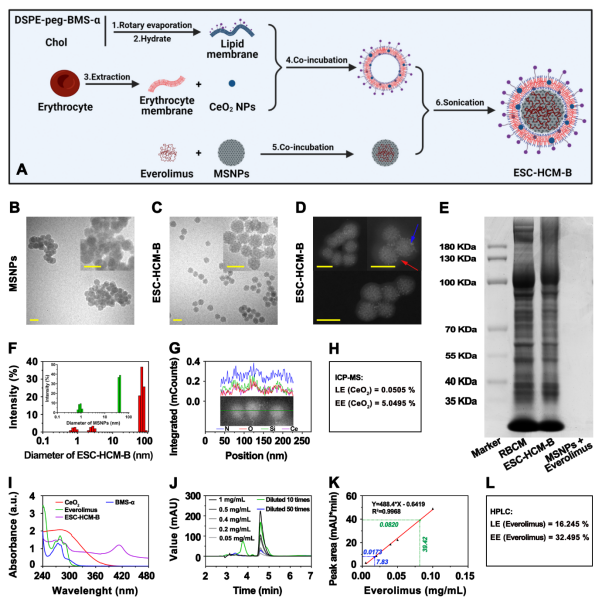
图2. ESC-HCM-B纳米药物的合成过程及理化性质
细胞毒实验和凋亡实验进一步证实,较依维莫司相比,ESC-HCM-B没有表现出明显的细胞毒性和促凋亡作用。而在高糖环境中,ESC-HCM-B表现出抵抗高糖诱导细胞凋亡的特性。我们在纳米平台中加载二氧化铈量子点作为抗氧化剂的存在,极大程度的降低了活性氧自由基(ROS)水平,从而保护足细胞免受氧化应激损伤。
本研究在体内实验中,将ESC-HCM-B运用到经典的糖尿病肾病STZ模型和Lep-/-模型中显示:ESC-HCM-B给药后4 h肾小球可见强红色荧光信号,且不随时间衰减;而肾小管红色荧光信号初期逐渐增强后迅速衰减,48 h几乎完全消失。生物透射电镜观察到纳米颗粒可穿透肾小球滤过膜,定位于足细胞溶酶体、细胞质及肾小球基底膜,提示完整ESC-HCM-B可成功穿过肾小球滤过膜实现对足细胞的靶向。小鼠血药浓度分析显示ESC-HCM-B组血中依维莫司浓度始终维持在较低水平,表明纳米颗粒在到达肾脏前没有过早释放引起血药浓度升高,从而避免了药物的全身不良反应的风险。免疫印迹实验进一步证实,ESC-HCM-B治疗组肾脏mTOR及其下游信号均明显减弱,免疫组化实验证实ESC-HCM-B治疗组肾脏纤维化明显改善。综上结果显示给予ESC-HCM-B有效改善糖尿病肾病进展。
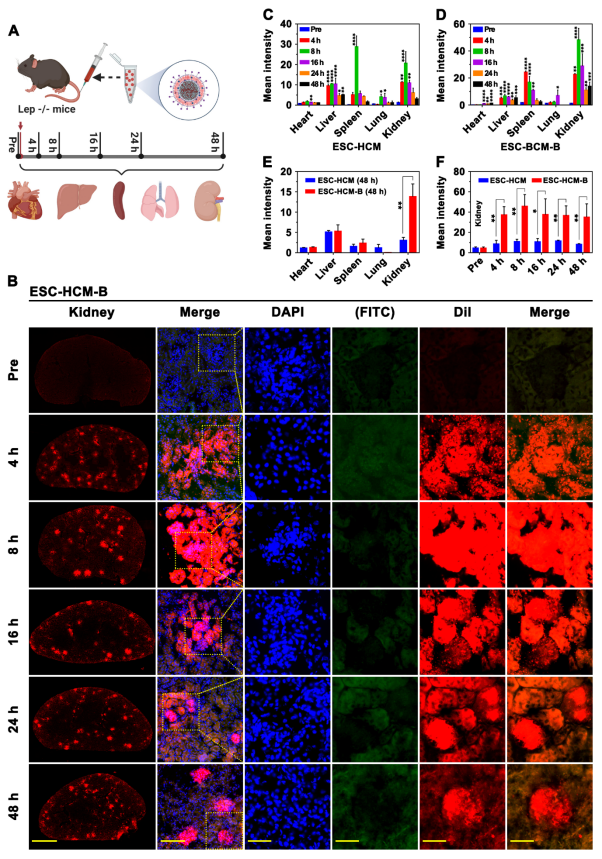
图3. ESC-HCM-B在动物模型中的肾脏靶向特异性
【结论与展望】
目前糖尿病肾病治疗的新药不断地涌现,凸显其严重的危害及糖尿病肾病治疗的困难和挑战。我们运用纳米技术,将多种药物靶向运送到足细胞,实现肾脏的精准靶向药物释放和治疗,有效的规避了药物的全身不良反应,提高了药物的局部治疗效果,并且针对糖尿病肾病异质性特点,将纳米平台多功能化修饰,实现了糖尿病肾病的多靶点治疗,为糖尿病肾病治疗的后续研发提供了新的思路。
重庆医科大学附属第二医院钟玲教授和曾粒主治医师为该论文的共同通讯作者。凡奎医师,袁世艺医师,周秘助理研究员,余渊副主任医师为本论文的共同第一作者。本研究得到国家自然科学基金,重庆市中青年医学高端人才项目,重庆市科委等项目支持。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c04671


