【AJH】成人非体外去T细胞haplo-PBSCT,监测ATG浓度的目标给药策略安全有效
时间:2023-09-25 20:15:00 热度:37.1℃ 作者:网络
ATG目标给药策略
在异基因造血干细胞移植(allo-HSCT)中广泛使用抗胸腺细胞球蛋白(ATG),其可促进植入,同时预防重度急慢性移植物抗宿主病 (GVHD),但ATG也可能增加感染和恶性肿瘤复发的风险:ATG暴露不足可能会降低其预防GVHD的功能,而ATG过量可能会延迟免疫重建,增加巨细胞病毒 (CMV)、EB病毒(EBV)再激活、非复发死亡和疾病复发风险。
尽管ATG给药的最佳剂量已经探索了数十年,但其对 HSCT 临床结局的药理学作用与供者来源、人类白细胞抗原 (HLA) 差异、预处理强度和GVHD预防相关,尤其是使用时间和剂量,但尚未确定ATG在成人非体外去T细胞单倍型相合HSCT(haplo-HSCT)中的最佳剂量。
在非体外去T细胞haplo-HSCT的GVHD 预防中,ATG通常以10mg/kg的累积剂量给药,但CMV和EBV再激活风险较高,累积剂量降至7.5mg/kg甚至6mg/kg也未显著降低CMV再激活风险。因此,考虑到活性ATG在患者中的药代动力学具有高度异质性,根据体重确定最佳ATG暴露量是无效的。
ATG与淋巴细胞结合后以活性形式发挥药理学作用,其暴露量表示为浓度-时间曲线下面积 (AUC)。在降低强度预处理 (RIC) allo-HSCT 中,最佳活性ATG-AUC可改善预后。为了获得血浆活性 ATG 浓度,中国人民解放军总医院第五医疗中心刘代红教授和窦立萍教授等开发了一种基于 HUT-78 T 细胞流式细胞术的活性 ATG 浓度检测方法,并于2022年在《Transplantation and Cellular Therapy》发表文章,定量了106例单倍型相合外周血造血干细胞移植 (haplo-PBSCT) 受者的活性 ATG 暴露,这些受者在预处理期间接受了 10mg/kg ATG 的常规固定剂量,发现从首次 ATG 给药至+60天的总 AUC 与移植后的临床结局相关。随后通过应用机器学习确定活性ATG-AUC的最佳范围为100-148.5 UE/mL/日,该最佳范围与 EBV/CMV 再激活减少相关,而不增加急性 GVHD 或恶性疾病复发。然后利用数学函数,根据-5天至-4天的活性ATG浓度,可确定-3天至-2天的ATG总目标剂量。
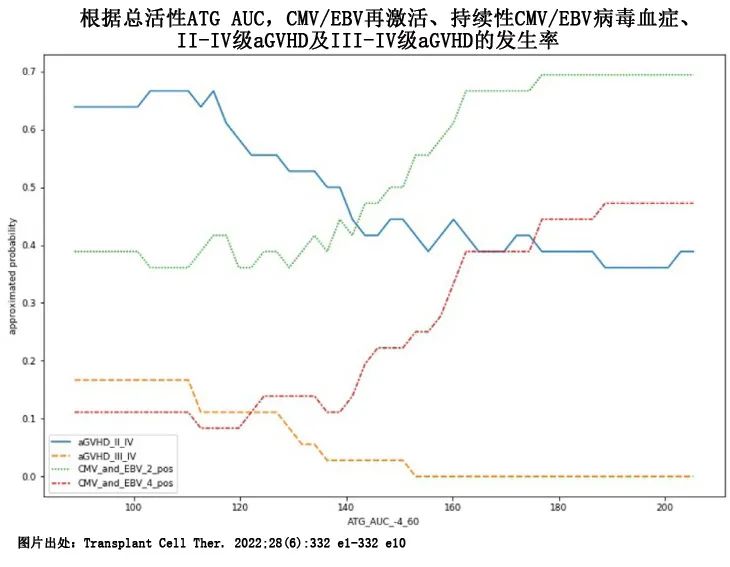
基于上述结果,作者首次在前瞻性单臂研究中实施了该ATG目标给药策略(ATG-targeted dosing strategy),以调整 ATG 剂量,旨在使活性 ATG 的总 AUC 落在“最佳范围”内。因此,本研究的目的是前瞻性验证ATG目标给药策略在接受 haplo-PBSCT 以减少 CMV 再激活且急性 GVHD 发生率可耐受的成人患者中的疗效和安全性。研究结果近日发表于《American Journal of Hematology》。

研究方法
该2期研究纳入完全缓解(CR)期接受首次清髓性预处理非体外去T细胞haplo-PBSCT的恶性血液病患者,患者在预处理期间接受兔ATG。
此外,选择连续接受haplo-PBSCT的102例患者组成的历史队列作为对照组,以比较移植结局。历史队列的患者从第-5天至第-2天接受的 ATG 总剂量为10mg/kg,其他移植方案与2期试验相同,包括供者选择、预处理方案、GVHD预防和支持治疗。
预处理包括从第-10天至第-8天给予白消安(3.2 mg/kg/天,iv),第-7天给予卡莫司汀 (250 mg/m2,iv),第-6天和第-5天给予阿糖胞苷(4 g/m2/天,iv),第-4天和第-3天给予环磷酰胺 (50mg/kg/d,iv)。ATG 给药时间为-5天至-2天。第0天输注粒细胞集落刺激因子 (G-CSF) 动员的外周干细胞。给予环孢素 (CSA)、吗替麦考酚酯和短期甲氨蝶呤 (MTX) 预防GVHD。给予重组人粒细胞集落刺激因子以支持植入。历史队列的移植方案与2期试验相同。
为预防重度过敏,传统上以递增剂量模式给予 ATG 4 天:-5天,1.5 mg/kg;-4天和-3天,2.5 mg/kg;-2天,3.5 mg/kg。根据剂量调整策略,在-3天和-2天进行两次单独给药。
主要终点为移植后+180天 CMV 再激活的累积发生率;次要终点为植入(+28天)、EBV再激活(+180天)、急性GVHD(+100天)、慢性GVHD(1年)、非复发死亡(NRM)(1年)的发生率以及1年无病生存率(DFS)和1年总生存率(OS)。
研究结果
患者特征和预测ATG剂量
共入组了66例患者,其中2例由于 ATG 浓度数据不完整而排除,1例由于在 ATG 给药前发生早期死亡而被排除,最终研究队列包括63例患者。其基本特征总结见表1。
60例患者 (95.2%) 的 ATG 目标剂量估计值介于 6-10 mg/kg 之间。其余3例患者分别为5.6、4.9和11.7 mg/kg,这3例患者的实际给药剂量分别为6、6和 10 mg/kg
疗效
该研究达到了预期 CMV 再激活减少的主要终点;63例患者中的23例 (36.5%) 发生 CMV 再激活,发生于haplo-PBSCT 后中位42天。37/63例 (58.7%) 患者发生 EBV 再激活,中位时间为36天。+180天 CMV 再激活的累积发生率为36.7%,EBV再激活的累积发生率为58.7%(图1)。+180天持续 CMV 抗原血症的累积发生率为20.9%,持续 EBV 抗原血症的累积发生率为38.1%。
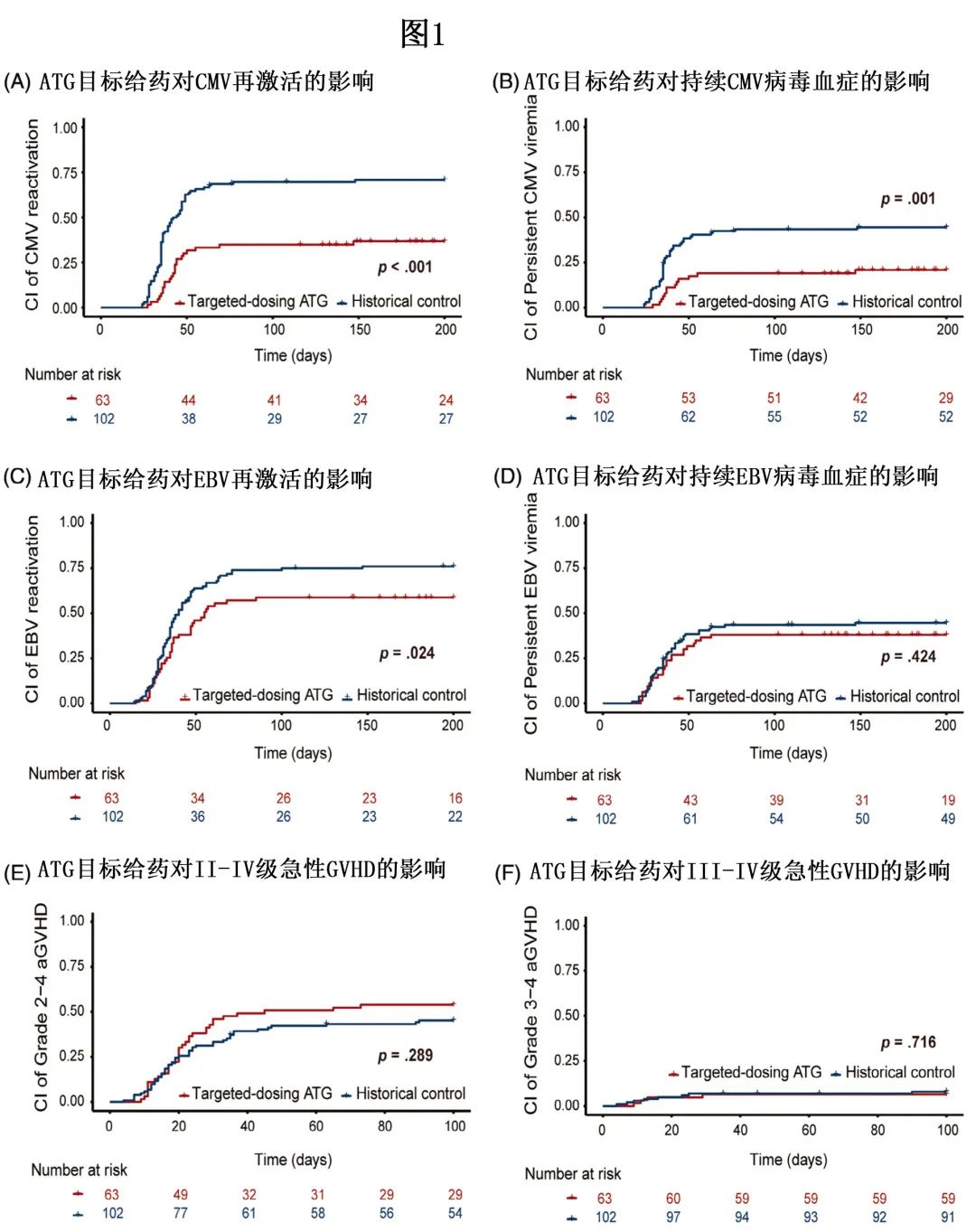
45例 (71.4%) 患者发生急性GVHD。+100天时II–IV级和III–IV级急性 GVHD 的累积发生率分别为54.0%和6.4%(图1)。13例 (20.6%) 患者发生慢性GVHD,其中轻度7例,中度5例,重度1例;1年时中重度慢性 GVHD 的累积发生率为8.3%,2年时为11.1%。
中位随访时间为632天。末次随访时10例 (15.9%) 患者复发,其中6例死于复发。
1年时的累积复发率 (CIR) 为13.1%,2年时为17.7。1年 NRM 为4.8%。1年和2年 DFS 分别为82.5%和78.2%。1年和2年 OS 分别为92.1%和82.4%(图2)。
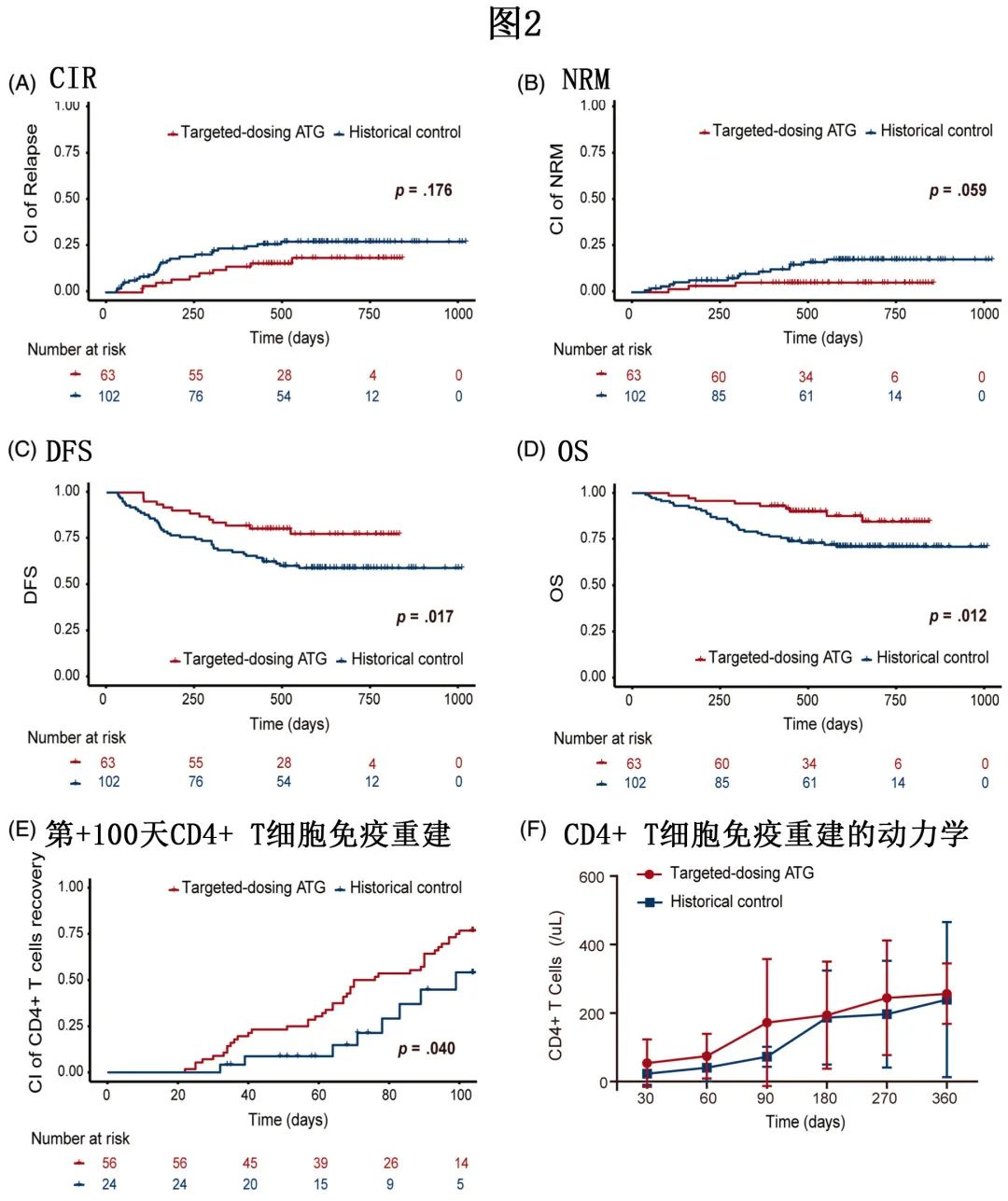
CD4+ T细胞重建(移植后100天内连续两次测量的CD4+ 细胞计数≥0.05X109/L)的发生率。对56例患者的数据进行了事后分析,2期试验队列中+100天时CD4+ T细胞免疫重建的累积发生率为76.8%,显著高于历史对照队列(54.1%;p=0.040,图2)。此外两组间CD3+ T细胞、CD8+ T细胞、B细胞和 NK 细胞的重建无显著差异。
安全性
未发生移植物失败,63例患者均获得完全供者嵌合体的植入,中性粒细胞的中位时间为13天,血小板恢复的中位时间为13天。3例患者死于非复发相关疾病,1例在+269天死于肺炎,1例在+96天死于肝静脉阻塞性疾病,1例在+148天死于迟发型急性 GVHD III 级伴肠道受累,但这些死亡与目标 ATG 给药均无关。
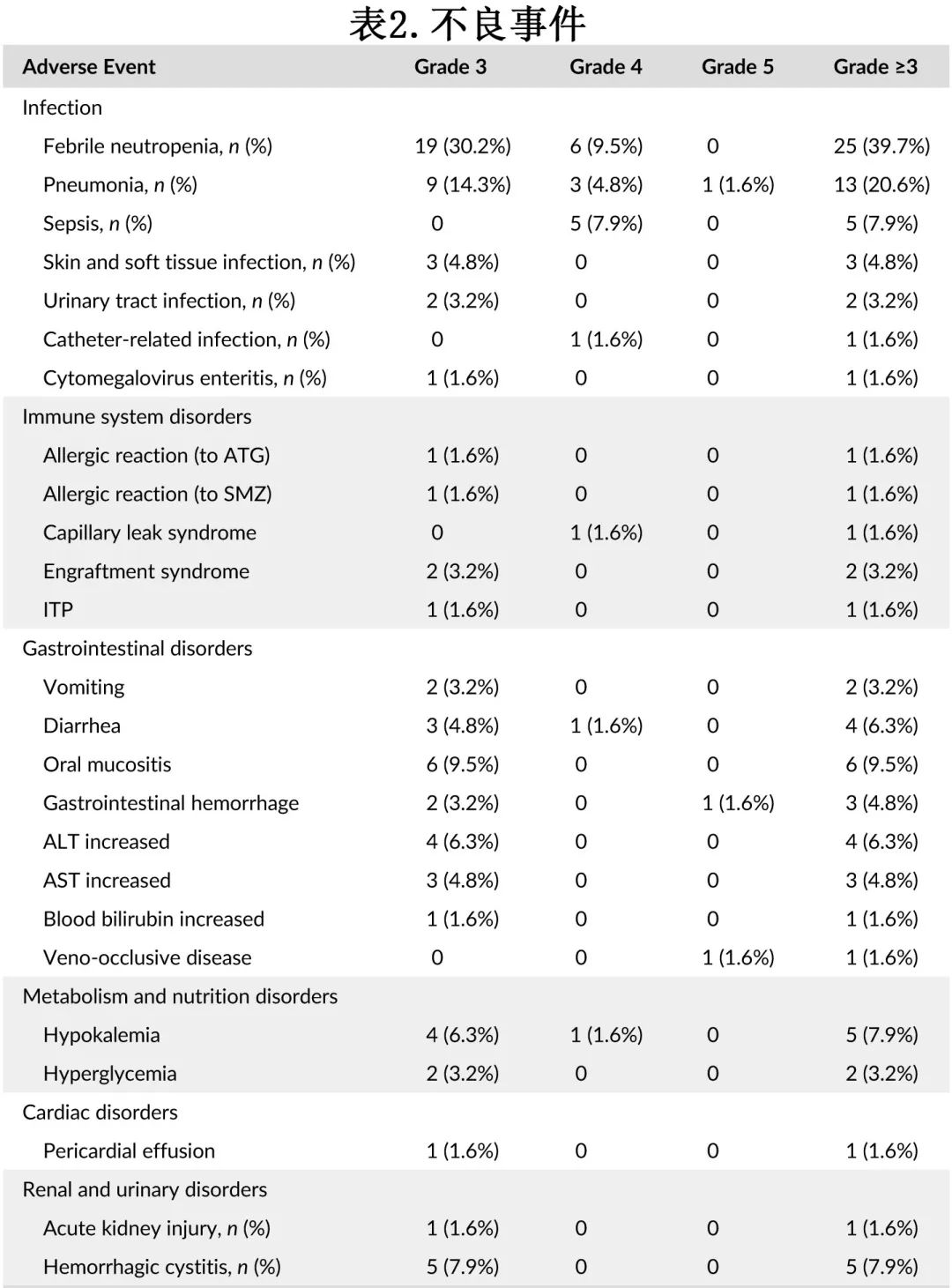
共记录了94起≥3级不良事件,其中73例 (77.7%) 为3级,18例 (19.1%) 为4级,3例 (3.2%) 为5级(表2)。最常见的≥3级不良事件为感染 (51.5%) 和胃肠道毒性 (25.5%)。所有不良事件均被认为是与 haplo-HSCT 相关的常见并发症。
与历史数据的比较
与历史对照队列相比,该队列在+180天时 CMV 再激活(70.8%vs. 36.7%,p<0.001,图1A)、持续 CMV 抗原血症(44.5% vs. 20.9%,p=0.001,图1B)和 EBV 再激活(76.0% vs. 58.7%,p=0.024,图1C)的累积发生率显著降低,但两组之间+180天持续 EBV 抗原血症的累积发生率无统计学显著性(45.0% vs. 38.1%,p=0.424,图1D)。多变量分析显示,目标ATG 给药与 CMV 再激活的减少独立相关(p<0.001)
第+100天的II-IV 级急性 GVHD(54.0% vs.历史对照的45.3%,p=0.289,图1E)或III–IV级急性 GVHD(6.4% vs. 7.9%,p=0.716,图1F)累积发生率均无统计学差异,2年中重度慢性GVHD(11.1% vs. 17.4%,p=0.632)同样无差异。
两个队列的1年CIR(13.1% vs. 历史对照的22.6%,p=0.176,图2A)或1年NRM(4.8% vs. 11.7%,p=0.59,图2B)无显著差异。1年 DFS(82.5% vs. 67.6%,p=0.017,图2C)和1年OS(92.1% vs. 73.5%,p=0.012,图2D)显示两个队列之间的生存期存在显著差异。多变量分析显示,目标ATG给药可改善DFS 和OS。
总结
该2期研究的目的为评价 ATG 靶向给药策略在成人非体外去T细胞haplo-PBSCT中的安全性和疗效。预处理期间给予 ATG 4 天(-5天至-2天),通过给药策略调整-3天和-2天的 ATG 剂量以达到最佳 ATG 暴露。主要终点是+180天的 CMV 再激活。共入组66例单倍体PBSCT患者,其中63例可评价,中位随访时间为632天。CMV 再激活的累积发生率为36.7%,EBV再激活为58.7%。1年无病生存率为82.5%,总生存率为92.1%,+100天 CD4+ T细胞重建为76.8%。最常见的治疗方案相关重度毒性(>3级)为感染 (51.5%) 和胃肠道毒性 (25.5%)。共有102名接受传统固定 ATG 剂量(累积10mg/kg)的单倍型PBSCT 患者组成历史对照,历史对照的结局劣于该2期队列(CMV再激活:70.8%,p<0.001;EBV再激活:76.0%,p=0.024;CD4+ T细胞重建:54.1%,p=0.040)。
该研究是第一项评估ATG 目标给药给药改善成人非体外去T细胞haplo-PBSCT后临床结局的前瞻性研究,证实目标给药策略时基于主动 ATG 浓度监测可确保 ATG 总暴露量在预定的最佳范围内,而最佳 ATG 暴露可确保稳定的植入,并减少 CMV/EBV 再激活,而不增加 GVHD 或复发的发生率,最终导致更优的 DFS 和OS。
总的来说,该单臂2期研究通过监测血浆活性 ATG 浓度,在非体外去T细胞haplo-PBSCT中证明了 ATG 目标给药策略的安全性和疗效,可减少单倍型PBSCT 后 CMV/EBV 再激活并改善生存期,而未增加GVHD;这些优势可能与加速免疫重建有关。但其降低病毒感染、改善 DFS 和 OS 的疗效必须在前瞻性、随机对照研究中得到验证。
参考文献
Wang H, Wang N, Wang L,et al.Targeted dosing of anti-thymocyte globulin in adult unmanipulated haploidentical peripheral blood stem cell transplantation: A single-arm, phase 2 trial .Am J Hematol . 2023 Sep 14. doi: 10.1002/ajh.27068.


