Curr Oncol Rep:CAR-T在LBCL一线和二线治疗中的作用演变
时间:2023-10-31 14:33:38 热度:37.1℃ 作者:网络
CAR-T与大B细胞淋巴瘤
CD19 CAR-T 细胞治疗改变了复发难治大B细胞淋巴瘤(R/R LBCL)的治疗格局,3项关键单臂2期研究ZUMA-1(axi-cel)、JULIET(tisa-cel) 和 TRANSCEND(liso-cel) 确定了它们的疗效,在三分之一的多线治疗患者中产生持久缓解,ZUMA-1 研究的5年随访分析也阐明了 axi-cel 的长期治愈潜力,估计的5年 OS 率为42.6%,排除与疾病进展无关的死亡后,5年疾病特异性生存率估计为51%。
CAR-T 细胞治疗作为R/R LBCL三线治疗的成功,催化了其作为二线治疗选择的探索,尤其是在标准治疗结局较差的临床背景中(包括难治性疾病或接受一线化学免疫治疗后12个月内早期复发)。两位专家近日于《Current Oncology Reports》发表综述,回顾了过去2年CD19 CAR-T 细胞治疗作为 LBCL 二线治疗的实践变化(practice-changing)研究,包括与标准治疗 (SOC) 比较的3项大规模3期研究,以及不适合移植患者或作为一线治疗一部分的最新2期研究。现翻译全文供各位老师参考。

对比CAR-T细胞疗法与标准疗法用于LBCL二线治疗的III期研究
3项大规模、国际 III 期前瞻性研究ZUMA-7(axi-cel)、BELINDA(tisa-cel) 和 TRANSFORM(liso-cel) 的总体原理,旨在确定无事件生存期 (EFS) 的主要终点在 CAR-T 细胞治疗组与二线 SOC 组(其特征未对挽救化疗有反应的患者ASCT)之间是否存在显著差异。这些研究使用了一线化学免疫治疗难治或治疗后1年内复发的R/R LBCL 患者人群。为了便于预期的比较,每项研究的两组所有患者必须为 ASCT 的可接受候选者;这些试验还允许广泛的挽救化疗选择。三个研究的设计、人口统计学、结局和毒性比较见表1。
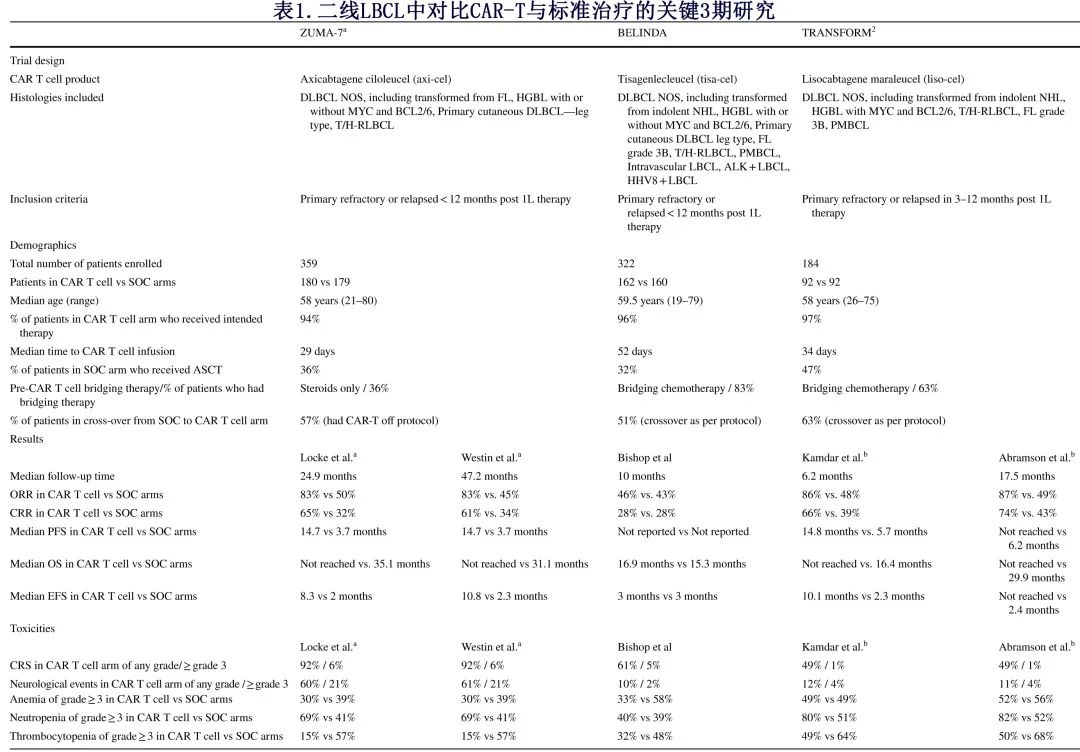
ZUMA-7研究以1:1的比例将359例患者随机分配至 axi-cel 组和 SOC 组。研究设计允许在 CAR-T 细胞输注前必要时使用类固醇达到临床稳定,但不允许桥接化疗。研究设计未计划交叉,但进展的 SOC 患者中57%在试验外接受了 axi-cel。虽然试验治疗组中94%的患者成功接受了axi-cel,但 SOC 患者中仅36%进行了ASCT。中位随访时间24.9个月的初步报告显示,与标准治疗相比,axi-cel组的中位EFS、完全缓解率 (CRR) 和总缓解率 (ORR) 显著更高(表1);仅观察到 OS 朝向 axi-cel 组的积极趋势。随后,在方案规定的自首例患者随机化后后5年间隔,报告了 ZUMA-7 的 OS 长期随访分析 [•](对于该文章参考的原文,作者强调为:•重要••极其重要)。中位随访47.2个月,axi-cel的 OS 显著长于SOC,死亡风险降低27.4%。此外在较长的随访时间范围内,axi-cel在 PFS 和 EFS 方面的优势持续存在,且未出现新的治疗相关死亡(表1)[•]。
BELINDA研究将322例患者随机分配至tisa-ce组和 SOC 组。在 tisa-cel 组中,83%的患者接受了试验方案允许的桥接化疗,95%的患者接受了预期的 CAR-T 细胞产品,但中位静脉-静脉时间长达52天。SOC 组允许使用最多2种不同的挽救性化疗;仅32%的 SOC 患者接受ASCT,而51%的 SOC 患者后来根据研究方案允许的交叉接受了tisa-cel。中位随访10个月,两组之间的结局指标均无统计学显著差异,包括EFS、CRR和ORR;未对 OS 差异进行正式分析。
TRANSFORM研究是3项研究中最小的,包括 liso-cel 组和 SOC 组共184例患者。在 lisocel 组中,63%的患者按照试验方案接受了桥接化疗,97%的患者按照计划接受了 CAR-T 细胞产品。SOC 组仅47%的患者接受了ASCT,而63%的患者后来根据研究方案允许接受了 liso-cel 作为交叉的一部分。中位随访时间6.2个月的中期分析显示,与 SOC 相比,liso-cel的EFS、CRR和 PFS 显著改善。17.5个月的长期分析中,liso-cel在这三种结局指标上相对于 SOC 的优效性持续存在(表1);与 SOC 相比,liso-cel在 OS 方面具有更有利的趋势,但无统计学显著性。
CAR-T细胞疗法二线治疗不适合移植LBCL患者的II期研究
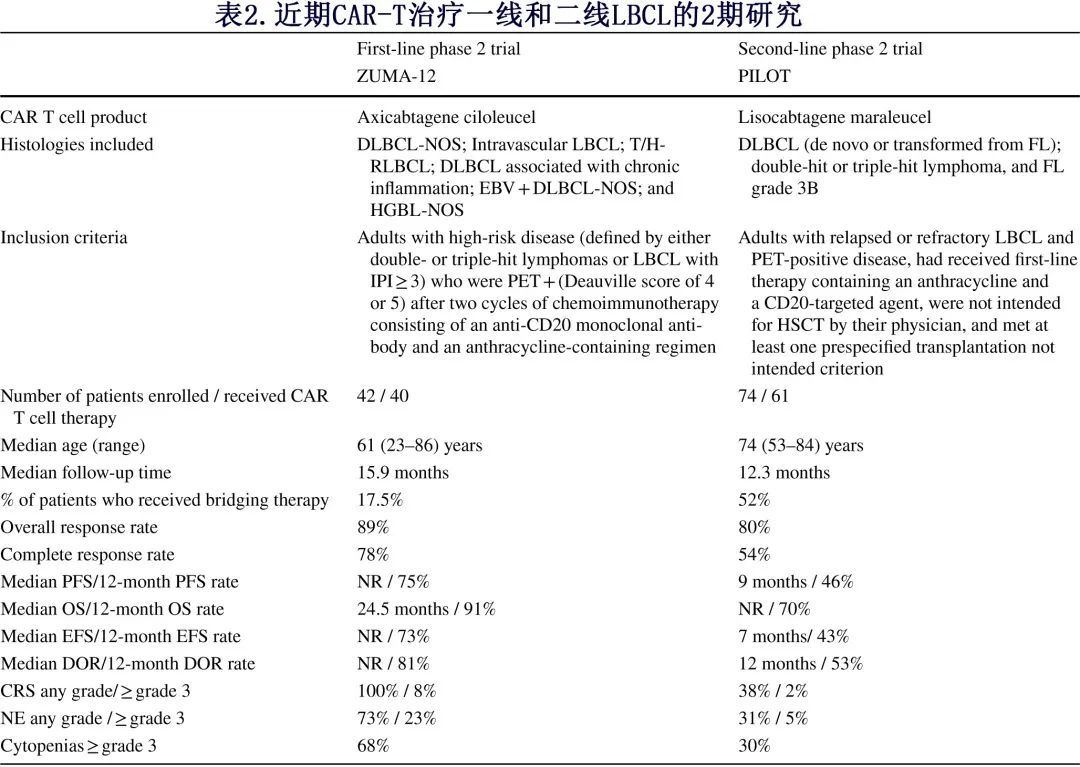
PILOT 是一项在不适合移植的R/R LBCL 成人患者中评价 liso-cel 作为二线治疗的疗效和安全性的开放标签、II期研究。值得注意的是,与二线 CAR-T 细胞的3期研究(将入组限制在一线治疗后1年内早期复发)不同,PILOT还纳入了复发晚于该时间段的患者。入组本研究的74例患者必须符合6项非预期移植 (TNI) 标准中的至少1项,这些标准根据美国和欧洲试验中心移植合格性的不同机构建议进行提炼,考虑了年龄(≥70岁)、功能状态(ECOG体能状态为2),并筛选了肺、心脏、肾脏或肝脏功能损害的定量指标。
在74例患者的初始入组人群中,61例患者最终接受了 lisocel 治疗;在研究设计中,CAR-T 细胞输注前允许使用全身药物和/或放疗进行桥接治疗。中位随访时间为12.3个月的评估显示ORR(试验的主要终点)为80%,CR为54%(表2)。中位 PFS 为9个月,中位 EFS 为7个月,未达到中位OS。中位 DOR 为12个月,而达到 CR 的患者的 DOR 更长,为21.65个月。重要的是,对于入组的中位年龄为74岁且因合并症而禁忌ASCT的老年人群,liso-cel的安全性特征未显示任何新的或增加的安全性信号。虽然49%的试验患者发生 CRS 和/或神经系统事件,但大多数为1级或2级,未发生与 CAR-T 细胞特异性毒性相关的死亡。最常见的≥3级副作用为血细胞减少。PILOT 中报告的毒性与既往报告的三线 TRANSCEND 和二线 TRANSFORM 研究中 liso-cel 的安全性特征一致。
CAR‑T作为高危LBCL一线治疗一部分的II期研究
ZUMA-12研究是首个评估 CAR-T 细胞疗法作为高危 LBCL 一线治疗一部分的疗效和安全性的前瞻性2期研究[••]。该研究纳入42例在诊断时具有两种预先定义的高危特征中至少一种的患者:IPI评分≥3、“双打击”或“三打击”淋巴瘤。该单臂研究中的患者最初接受两个周期的免疫化疗,包括含蒽环类药物的方案和抗 CD20 单克隆抗体。第2周期后 PET 扫描显示所有患者均存在残留病灶,随后接受白细胞单采和 axicel 输注。研究设计允许在白细胞单采后进行基于非化疗的桥接治疗,且7例患者使用。
在37例患者的可评估患者中,ORR为89%,CRR为78%,符合研究的主要终点。在双或三打击淋巴瘤中,上述疗效结局优于标准免疫化疗(R-CHOP或剂量调整的R-EPOCH)的CRR≤60%。axi-cel持久缓解,73%的患者在中位随访时间15.9个月后保持缓解。这项一线研究的一个有趣发现在于,与之前在三线治疗中使用 CAR-T 的 ZUMA-1 研究结果相比,输注后 CAR-T 细胞的扩增更稳健。ZUMA-12 的安全性特征也与之前报告的 axi-cel 治疗广泛低级别 CRS 和血细胞减少的安全性特征一致,但仅少数患者发生高级别(≥3)CRS或神经系统事件(表2)[••]。未发生给药相关死亡。
讨论
基于ZUMA-1(axi-cel)、JULIET(tisa-cel) 和 TRANSCEND(liso-cel) 这三项关键性2期研究的疗效和安全性结果,CAR-T细胞疗法首次获批临床用于LBCL的三线治疗。这些初始研究、及其长期随访分析和 CAR-T 细胞在三线治疗环境中实际使用的研究的累积证据,导致了细胞治疗在 LBCL 早期治疗线中的研究。
CAR-T与SOC相比作为R/R LBCL二线治疗的生存获益
III 期研究ZUMA-7(axi-cel)、BELINDA(tisa-cel) 和 TRANSFORM(liso-cel) 将CAR-T 细胞产品与公认的二线标准挽救化疗后自体干细胞移植进行了比较。ZUMA-7 和 TRANSFORM 的初步分析表明,与标准治疗相比,axi-cel和 liso-cel 的 EFS 主要结局显著延长。这些研究的另一个关键次要终点为OS,与 EFS 不同,OS具有不受观察者偏倚影响的优势。ZUMA-7 的长期随访分析已明确确定,与标准治疗相比,接受二线 axi-cel 的患者的 OS 显著延长 [••]。这些令人兴奋的结果意味着与标准治疗相比,早期复发或难治性LBCL二线治疗在近30年首次获得生存改善。ZUMA-7 和 TRANSFORM 的累积证据支持将二线治疗作为原发难治性或早期复发性 LBCL 的范例,复发时间是决定 LBCL 二线治疗时需要考虑的重要因素。有证据表明,与早期复发或难治性患者相比,适合移植的晚期复发患者接受挽救性化疗和 ASCT 后的结局更佳,尤其是一线免疫化疗后复发超过2年复发的患者。这种结局差异反映出两组疾病类型极具差异的患者,晚期复发患者肿瘤样本中的基因突变模式与早期复发患者样本中的基因突变模式显著不同。
不同CAR-T产品二线治疗R/R LBCL的III期研究结果不一致
CAR-T 细胞治疗二线治疗R/R LBCL 的3项3期研究重点关注 EFS 的相同主要结局,但产生了不一致的结果。虽然 ZUMA-7 和 TRANSFORM 发现与 SOC 相比,axi-cel和 liso-cel 的 EFS 显著延长,但 BELINDA 未显示 tisa-cel 的相似获益。这种差异可能与研究设计、研究人群特征以及 CAR-T 细胞产品的性质及其给药的差异有关。值得注意的是,在确定用于 EFS 计算的事件方面也存在差异:所有研究均将死亡、疾病进展和疾病稳定性和/或缓解评估视为事件,但这些评估的时间点不同;此外BELINDA 未将6周时的 PET 扫描或可能需要第二种桥接化疗视为事件。
导致试验间 EFS 结果不一致的另一个关键因素可能在于 BELINDA 研究中侵袭性更强的患者比例相对更高:高危亚组(如ABC亚型、HGBCL和 IPI 评分≥2)的患者比例相对较高,以及 BELINDA 中 CAR-T 细胞前需要桥接化疗的患者比例 (83%) 高于TRANSFORM(63%);值得注意的是,ZUMA-7研究方案允许在 CAR-T 细胞治疗前使用类固醇治疗,但不允许桥接化疗,可能会导致疾病侵袭性较低的患者比例增加。此外,BELINDA标准治疗组只有32%的患者接受ASCT,这是各研究中发生率最低的。尽管 BELINDA 标准治疗组的患者被允许在ASCT 前接受最多两线挽救化疗(与 ZUMA-7 中允许的单线治疗不同),但该发生率较低,这再次反映了 BELINDA 研究人群侵袭性更强。
最后,BELINDA研究中白细胞单采与 CAR-T 细胞输注之间的中位时间间隔最长,可能会增加疾病进展风险和总体肿瘤负荷(两者均会对 CAR-T 细胞治疗的反应产生不利影响)。
CAR-T作为不适合移植和老年R/R LBCL患者的二线治疗选择
二线 CAR-T 细胞治疗的3项3期研究仅纳入适合 ASCT 的患者,以便于比较 CAR-T 与SOC。尽管试验最初受到限制,但 SOC 组中继续接受 ASCT 的患者比例较低。ZUMA-7 和 BELINDA SOC 组中约1/3的患者和 TRANSFORM SOC 组中不到一半的患者接受了ASCT。这些低 ASCT 率与既往报告一致,证明传统铂类药物化疗难以获得 CR 或 PR 以进行ASCT。值得注意的是,每项研究 SOC 组中接受 ASCT 的患者比例均低于之后交叉接受 CAR-T 的患者比例,CAR-T可作为研究设计中允许的交叉治疗的一部分 (BELINDA,TRANSFORM) 或作为方案外治疗 (ZUMA-7)。适合 CAR-T 细胞治疗的R/R LBCL 患者库大于 ASCT 患者库,这是因为 ASCT 不适用于补救性化疗无反应的患者,并且 ASCT 候选者的筛选具有排他性。ASCT 合格性的评估在不同实践环境中可能存在很大差异,但通常是基于年龄、合并症和功能状态来预测患者耐受移植的能力。
不适合移植的老年患者几乎没有有效的根治性治疗选择,预后不佳,报告的复发后中位 OS 小于6个月。因此CAR-T细胞疗法为老年患者亚组提供了一种急需的新治疗选择。值得注意的是,在所有二线 CAR-T 的3期研究中,约三分之一的患者年龄>65岁;ZUMA-7 和 BELINDA 没有最大年龄限制,而 TRANSFORM 的患者年龄小于75岁。
越来越多的证据表明,不同的 CAR-T 细胞疗法在老年患者(通常定义为≥65岁)中具有疗效。在 axi-cel 作为三线治疗的 ZUMA-1 研究中,对该人群进行的亚组分析发现 CR 和 ORR 率与年轻患者相似。ZUMA-7研究老年患者的亚组分析发现,与二线标准治疗相比,axi-cel具有更优的 EFS 和ORR;此外老年人的制备成功率和 CAR-T 细胞扩增率与整体人群相似。虽然 TRANSFORM 未招募>75岁或不适合 ASCT 的患者,但亚组分析确实发现,与年轻患者相比,lisocel在65-75岁患者中的 EFS 相似。2期 PILOT 研究评估了 liso-cel 作为不适合移植的复发或难治性 LBCL 患者二线治疗的疗效,其主要为老年患者队列,中位年龄为74岁,获得高ORR且达到 CR 的患者持久缓解。一项回顾性分析发现 CAR-T 细胞疗法在老年R/R LBCL 患者中具有有利有效性的真实世界证据,包括与临床试验文献中报告的相似的持续缓解率,但该研究也强调了 CAR-T 细胞治疗在老年人中的使用不足,以及在该患者人群中存在获得治疗的障碍。
CAR-T作为R/R LBCL二线治疗的相关毒性和成本
CAR-T用于二线治疗的安全性特征与既往三线研究基本一致。观察到的毒性包括 SOC 组中贫血、血小板减少症和发热性疾病的发生率通常高于相应的 CAR-T 细胞治疗组(表1)。与免疫治疗相关的独特毒性包括细胞因子释放综合征 (CRS) 和神经系统事件,每个 CAR-T 细胞组中都很常见,但大多数病例的级别较低(表1)。Axi-cel 具有 CD28 共刺激结构域,严重3级CRS(6%的患者)和神经系统事件(21%的患者)的发生率高于 liso-cel 和tisa-cel(4-1BB 共刺激结构域),这一发现与之前三线研究和 CAR-T 细胞使用的真实世界证据研究中报告的趋势一致。但重要的是,不同研究中未报告治疗相关死亡的差异 [•]。
对 ZUMA-7 和 TRANSFORM 研究中患者的患者报告结局 (PRO)量表进行分析发现,与 SOC 组患者相比,CAR-T细胞组患者的 HR-QOL 始终较高,症状负荷始终较低。另一项重要的随访研究评估了二线 CAR-T 细胞治疗R/R LBCL 的成本效益,发现如果在 ZUMA-7 数据的初始分析中观察到的绝对 EFS 获益具有长期持久性,则二线 axi-cel 在特定的R/RDLBCL 患者中暂时具有成本效益。
CAR-T在高危LBCL一线治疗中的作用
开创性的2 期ZUMA-12研究发现,作为 LBCL 一线治疗的一部分,使用 axi-cel 具有较高的CRR、持久的缓解和可控的安全性特征[••]。在双打击或三打击淋巴瘤的高危患者组中,其缓解率与既往报告的单纯免疫化疗相比更佳。这项研究有一项新发现,即与早期三线使用的报告相比,当用于一线治疗时,CAR-T细胞的扩增更稳健,这具有重要意义,需要进一步阐明。该数据可能支持,CAR-T 用于具有更健康天然 T 细胞(可产生更高质量产品)的初治患者的临床疗效更高。
目前尚无 CAR-T 细胞治疗与标准治疗在一线高危 LBCL 的3期对照数据,因此进行中的评估 axi-cel 与免疫化疗的 III 期ZUMA-23研究结果值得期待,其有助于进一步描述 CAR-T 细胞治疗在 LBCL 治疗中的一线作用。目前正在研究的另一个有前景的产品是rapcabtagene autoleucel(YTB323),这是一种新一代抗CD19 CAR-T 细胞,由一种新型生产工艺产生,快速周转时间为2天;来自二线和三线治疗的有前景的数据激发了其潜在一线使用的兴趣。
总结
CD-19 CAR-T在过去几年内迅速改变了LBCL的治疗格局。最近的III期研究表明,与现有标准治疗相比,二线使用axi-cel和liso-cel治疗难治性和早期复发LBCL 的总生存期和/或无事件生存期更优;通过在老年和不适合移植的患者中证实疗效,还扩大了 LBCL 的根治性治疗范围。初探性和正在进行的研究中新出现的数据,强调了一线 CAR-T 细胞治疗改善LBCL高危亚型病程的潜力,这些亚型在过去对化疗相对棘手。抗 CD19 自体细胞治疗作用的动态演变、其他有前景的药物如双特异性 T 细胞结合抗体的出现和异基因现成细胞治疗的持续工作,将对 LBCL 不同靶向治疗的最佳顺序提出新的问题,在 CAR-T 细胞治疗后复发的患者中,不同治疗方式的潜在组合具有协同获益和下一步。
CAR-T 细胞治疗 LBCL 范围的持续扩大,也突出了几个亟待解决的问题。除了继续降低高成本、扩大生产能力和缩短输注前等待时间外,缓解 CAR-T 细胞获取方面存在的社会经济、种族和地理差异也至关重要。了解和克服 CAR-T 细胞相关毒性的潜在机制,以及驱动细胞治疗耐药的机制,对于进一步优化这种革命性治疗方式对 LBCL 患者的获益也至关重要。
参考文献
Lionel AC,Westin J.Evolving Role of CAR T Cell Therapy in First‑ and Second‑Line Treatment of Large B Cell Lymphoma.Curr Oncol Rep . 2023 Oct 20. doi: 10.1007/s11912-023-01466-6.


