脓毒症的体温控制
时间:2023-11-18 21:36:00 热度:37.1℃ 作者:网络
发热可以看作是对感染的适应性反应。脓毒症的体温控制旨在预防与高温相关的潜在危害(心动过速、血管舒张、电解质和水分流失),治疗性低体温可能旨在减缓代谢活动并保护器官免受炎症。虽然高热(>39.5°C)控制通常用于危重患者,但现有的队列和随机对照试验不支持将其用于改善脓毒症预后。最后,自发性和治疗性低体温都与脓毒症的不良结局有关。
引言
发热(或发烧)是脓毒症和脓毒性休克的常见特征。尽管多个科学协会已将发烧定义为高于 38.2°C 的体温,但作者之间的实际阈值差异很大 。发热通常是感染的症状,但重症监护中至少有 25% 的高热不是感染性的,而是肿瘤性、缺血性或过敏性的。长期以来,人们一直认为发烧对感染有益,因为许多细菌在高温环境中的复制较少。然而,非常高的温度会导致器官损伤或衰竭。
多年来,脓毒症患者的体温控制一直是一个悬而未决的问题。最近对脓毒症发热的研究分离出了不同预后的患者群体。这一点,再加上对微生物群的进一步了解,可能会让我们考虑以更加个性化的方式对待发热的正确态度。
在这篇综述中,我们将从病理生理学和临床角度总结脓毒症发热的最新进展。
病理生理学
发热的生理病理和细胞变化
体温由下丘脑严格调节,范围在 0.2-0.4°C 之间,昼夜变化很小。平衡由传入、中枢和传出系统维持。信息来自主要位于皮肤的热感受器。当外部或中枢温度发生变化时,下丘脑会激活传出通道,通过颤抖、出汗或重新分配血流来维持体温。由于外部加热、产热过多或散热效率低下,发热通常可与无感染的高热相区分。在高热症中,下丘脑试图维持体温正常,但却力不从心。发热是下丘脑通常的目标或设定点(通常在 37°C 左右)升高的结果。导致发热的细胞外和细胞内信号转导如图 1 所示,但各种分子在下丘脑中的确切作用位置仍不清楚。
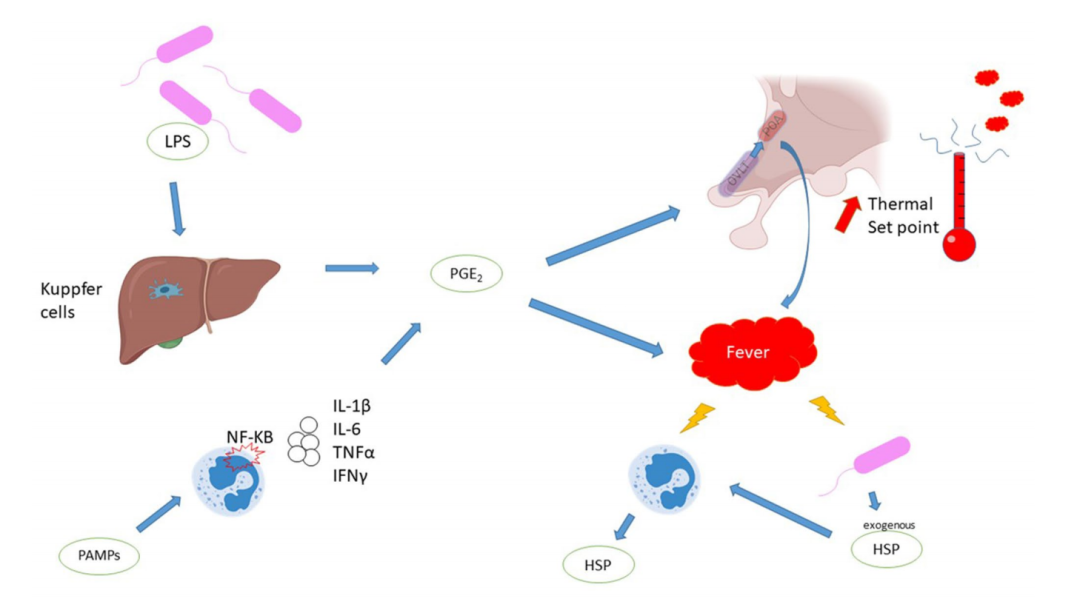
图 1. 发烧的机理。评论:PGE2 是发热的主要成分。PGE2 可诱导下丘脑设定点升高,并促进外周产热。PGE2 通过两种途径合成:外毒素直接刺激 Kuppfer 细胞,或通过病原体相关分子模式/Toll 类受体(PAMPs/TLR)途径刺激白细胞,导致产生内源性热原。发热有多种分子后果,热休克蛋白是对发热的一种关键反应。图例:HSP,热休克蛋白;IFN,干扰素;IL,白细胞介素;LPS,脂多糖;NF-KB,核因子-kappa B;OVLT,顶膜血管器官;PAMPs,病原体相关分子模式;PGE2,前列腺素 E2;POA,视前区;TNF,肿瘤坏死因子。
从细胞角度和体外实验来看,发热的影响是有争议的。较高的温度会抑制肺炎链球菌和流感嗜血杆菌的生长。在小鼠肺炎模型中,高热组的细菌量明显较低。对抗菌剂的敏感性随温度升高而增加,尤其是当温度超过 38.5°C 时 . 温度越高,抗生素对葡萄球菌和铜绿假单胞菌生物膜的效果越好 . 在宿主方面,已知高温会诱导具有细胞保护特性的热休克蛋白(HSPs)。发烧会促进病原体产生热休克蛋白,而热休克蛋白则是宿主先天防御的强大激活剂。发热似乎会增强先天性免疫反应,先天性免疫细胞的招募会增加,中性粒细胞的存活率会提高,NETosis 会改善,活性氧的产生会增加,中性粒细胞分泌的促炎细胞因子会减少。其他数据显示了对适应性免疫系统的影响,CD4+ T 细胞分化和适应性免疫细胞招募发生了变化。
但也有有害影响的描述。高热具有细胞毒性,在 41°C 时可导致细胞直接死亡。先天性免疫反应增强的同时,组织损伤也会增加,尤其是肺泡上皮或神经元损伤。此外,温度越高,新陈代谢越旺盛,耗氧量也越高,而在脓毒症和休克情况下,氧是细胞的稀缺资源。例如,发热会诱发心动过速,从而增加心脏耗氧量。高温有利于动脉血管扩张,从而降低动脉压。高热是凝血的有效催化剂。其根本机制可能是白细胞和微颗粒增加了组织因子的暴露。中性粒细胞、组蛋白和 NETosis 也可能是凝血因子结合的启动因子和促进因子。
肠道微生物群的影响
最近,微生物群领域的知识不断增长,人们开始思考肠道微生物群能否解释脓毒症症期间体温异质性的问题。最近的一项研究根据患者的体温变化轨迹将其分组。他们在进入重症监护室(ICU)时的肠道微生物群进行了比较。肠道细菌群落的组成与个体的体温轨迹独立相关,小鼠模型加强了这一假设。某些类群,如Lachnospiraceae spp.,可能有利于脓毒症患者降低体温。同一作者还证明,肺部微生物群中也存在这种特定的类群,它与危重病人更差的预后有关。
在 COVID-19 患者中,发热与肠道微生物群的改变有关,如粪肠球菌和酿酒酵母菌的增加。在中性粒细胞减少性发热中,肠道微生物群的改变和耗竭可能与保护性微生物群衍生代谢物的丧失有关。Akkermansia类群通过粘液稀释与中性粒细胞减少性发热的发病机制密切相关。
肠道微生物群与生物体之间的相互作用似乎是双向的。在脓毒症小鼠模型中,宿主通过适应来维持肠道微生物群。注射 LPS 后,小肠上皮细胞通过释放岩藻糖进行适应。然后,微生物群消耗岩藻糖以维持其生存。这种现象与提高对感染的耐受性有关。
发热的临床影响和预后价值
从无菌环境中获得的启示
中暑是高热造成危害后果的典型例子。典型的中暑表现为神经系统症状、呼吸性碱中毒,严重者会出现肝功能障碍、肾功能衰竭、急性呼吸窘迫综合征,甚至死亡。另一种与温度相关的疾病模式是恶性高热。它被描述为全身麻醉期间的一种不良反应。其症状多种多样,且患者之间存在差异。
在急性脑损伤中,发热与较差的预后有关,但目标体温管理未能改善患者的预后。心脏骤停患者经常出现高热,与神经系统预后较差有关。心脏骤停患者的管理指南包括在最初 24 小时内将体温积极控制在 36°C 以下,并在最初 72 小时内预防发热。
在入住重症监护病房的无脓毒症患者中,体温最高(>39.5°C)的患者预后最差。可能的解释是,他们受到高体温的负面影响,而没有所谓的对感染性疾病的益处。
脓毒症中的发热
全球各 ICU 中心对脓毒症 ICU 患者发热的定义各不相同,中位临界值为 38.2°C(IQR 38-38.5°C)。据报道,使用温度计的方法多种多样,腋窝、鼓膜和膀胱部位是最常见的主要方式。
据报道,重症监护室中约有 60% 的脓毒症患者会发热。约有 10-30% 的脓毒症患者在入院时可能体温过低。一项对 42 项研究进行的系统性回顾显示,发热超过 38°C 的脓毒症患者死亡率为 22.2%(CI,19.2-25.5),体温正常患者的死亡率较高,为 31.2%(CI,25.7-37.3),体温过低(<36.0°C)患者的死亡率最高,为 47.3%(CI,38.9-55.7)。Meta回归显示体温与死亡率之间存在很强的负线性关系。
与非脓毒症患者相比,体温过高并不会影响重症监护病房中脓毒症患者的预后。这一点同样适用于重症监护病房收治的中性粒细胞增多症患者(无论是否患有血液恶性肿瘤)。相反,低体温与预后不良和 ICU 获得性感染发生率较高有关 . 低体温程度越深,影响越大。其中一个原因可能是脓毒症的诊断和治疗延迟。儿童、新生儿和中性粒细胞减少的人群在体温过低时死亡率也较高。然而,在老年脓毒症患者中,体温过低更为常见,且与死亡率无关。
有趣的是,脓毒症患者的体温曲线可能与室外温度有关。在德国重症监护病房的脓毒症患者中,体温与室外温度有独立的关系。当室外温度高于 15°C 时,感染更为常见,而当室外温度低于 4°C 时,低体温更为常见。这可能会导致其他研究在比较发热和低体温时出现混杂偏差,因为它们可能在一年中不同的时间发生。有一项研究表明,随着室外温度的升高,院内菌血症的发病率也会升高,从而证明了这一点。
通过检查体温轨迹,描述了 4 种表型:快速分解性高热、缓慢分解性高热、正常体温和低体温。低体温多见于年龄较大的患者,而慢溶性高热患者年龄最小,合并症最少。速效高热患者的死亡率最低(3%),而低体温患者的死亡率是速效高热患者的三倍(10%)。在中性粒细胞增多症患者中,缓慢恢复期高热患者的死亡率最高。持续高热的中性粒细胞增多症患者可能受到多重耐药菌、真菌感染的影响,或与侵入性设备有关,这可能是他们预后不良的原因。
体温轨迹的另一个用途是预测医院获得性脓毒症。在一项病例对照研究中,发热前的体温变化(频率、幅度或逐渐升高)是脓毒症的早期标志物,可帮助人们更早地识别脓毒症。
如何控制脓毒症患者的发热?我们应该这样做吗?
重症监护室之间的温度控制存在差异。2012 年对 EUROBACT 参与者进行的一项调查发现,只有 22% 的重症监护病房制定了体温控制管理规范。据报道,几乎所有神经系统受损的患者和大多数急性冠状动脉综合征、感染、严重脓毒症和脓毒性休克患者都接受了体温控制治疗,但大多数肝功能衰竭患者的情况并非如此。
目标体温管理 (TTM) 一段时间以来一直是脓毒症的热门话题。虽然没有证据表明体温过高会增加患者的死亡率,但作者指出,脓毒症环境之外的有害影响是探讨脓毒症目标体温管理效果的原因。目标体温管理的预期有益效果是降低新陈代谢和增加血管张力。在尝试目标体温管理之前,必须使用抗生素控制感染。
对TTM 的影响
扑热息痛
扑热息痛的作用是通过降低下丘脑设定点来实现的,但其确切机制尚不清楚。这种药物及其安全性已得到公认。主要的副作用是肝细胞溶解,最严重的情况下会导致肝功能衰竭。在疗效方面,"HEAT "试验涉及 700 名发烧(>38°C)的脓毒症患者。患者被随机分配服用扑热息痛或安慰剂。研究结论是,对重症监护室的住院时间和死亡率没有影响(相对风险 0.96,P = 0.84)。不过,该研究有两个不足之处:患者发热时间较短,两组体温差异不大。
非甾体抗炎药
非甾体抗炎药通过抑制环氧化酶最终减少 PGE2 的产生。非甾体抗炎药广泛用于非卧床情况、良性和/或病毒性发热。最常见的副作用是胃肠道出血,但也可能出现肾脏和肝脏副作用。脓毒症的主要障碍是有可能导致感染恶化。
所有试图证明非甾体抗炎药可提高存活率的尝试都失败了。Haupt 等人将 29 名脓毒症患者随机分配给布洛芬或安慰剂,虽然显示出解热作用,但未发现对死亡率有任何影响。他们在次要结果(包括细胞因子水平)中也未发现差异。Bernard 等人进行了一项双盲随机对照试验,其中包括 455 名脓毒症患者。尽管布洛芬能减少前列环素和血栓素,降低发热、心动过速、耗氧量和乳酸酸中毒,但它并不能阻止休克的发生或改善死亡率。Morris 等人将 120 名患者随机分为布洛芬和安慰剂两种。布洛芬可降低体温,但对预后没有影响。最后,Memiş 等人对 40 名重症脓毒症患者随机使用洛诺昔康或安慰剂进行了比较。他们发现结果、生物参数(包括细胞因子水平)均无差异。
外部降温
物理方法包括表面冷却和血管内设备。表面冷却的范围包括简单的皮肤暴露或冰袋,以及专用设备。除空气循环毯外,在诱导正常体温方面没有区别。血管内设备本身存在与中央血管通路相关的风险。物理降温不会影响中枢控制,而是通过直接消除热量发挥作用。下丘脑的回复会导致寒颤、心动过速和外周血管收缩,所有这些都会使患者感到不适,并可能增加耗氧量。因此,应避免寒颤,并可通过镇静和神经肌肉阻滞来防止寒颤。
Schortgen 等人进行了外部降温与安慰剂比较的主要试验,该试验涉及 200 名脓毒性休克患者。达到体温正常的降温方法按照当地程序进行。主要终点,即 48 小时内血管加压剂减少 50%的患者人数没有差异(72% 对 61%;绝对差异:11%;95%CI,-23 对 2),但第 14 天的死亡率显著降低(19% 对 34%,P = 0.013)。在第 30 天没有发现死亡率差异。
我们应该控制高热吗?
随着 TTM 在心脏骤停治疗中的广泛应用,重症医学专家逐渐将其应用扩展到脓毒性休克。在一项脓毒性休克患者的回顾性队列中,超过 75% 的高热患者接受了对乙酰氨基酚治疗,一小部分患者甚至接受了甲基强的松治疗。此外,肾脏替代疗法和任何其他体外循环疗法都会降低体温,但这并不是它们的预期用途。尽管已有数据,但脓毒症生存运动指南并未提及这一主题。
由于脓毒症的高热表现预后较好,人们可能会质疑脓毒症患者退热的必要性。在一项原始设计中,预防极高热(T > 39°C)并不能防止器官功能障碍。在两项关于接受机械通气的脓毒症患者的研究中,更好的体温控制并没有改善血流动力学或呼吸状况。但正如埃文斯等人的回顾性研究所示,当体温非常高时,这种效果就会被抵消,最高体温超过 39.4℃时,就失去了对生存的有利影响。然而,在同一项研究中,退烧药并不影响存活率。
对包括药物诱导和外部降温在内的最大规模试验和观察性研究(1,507 名患者)进行的荟萃分析表明,在随机研究(相对风险,0.93;95% CI,0.77-1.13;I2 = 0.0%)或观察性研究(几率比,0.90;95% CI,0.54-1.51;I2 = 76.1%)中,退热疗法并未降低 28 天的住院死亡率。
在单个患者数据荟萃分析中(1413 名纳入患者中有 95% 在基线时受到感染),即使在基线体温超过 39.5°C 的亚组中[危险比为 0.76 (0.35-1.67)],更积极的发热管理与不太积极的发热管理相比,对生存时间的改善也没有统计学意义[危险比为 0.91;(95% CI 0.75-1.10),p = 0.32]。在一项敏感性分析中,荟萃分析结果表明,在使用血管加压素支持的机械通气患者中,体温管理的积极性较低[n = 595,危险比 1.21 (1.00-1.45)]。
最近的另一项荟萃分析包括 5 140 名参与者、23 项评估退热药物、物理降温或两种方法的试验,发现了类似的结果。对试验进行的荟萃分析和序列分析表明,退热疗法可降低死亡风险(风险比 1.04,95% 置信区间 0.90 至 1.19;I2 = 0%;p = 0.62;16 项试验;高确定性证据)和严重不良事件风险(风险比 1.02,0.89-1.17;I2 = 0%;p = 0.78;16 项试验;高确定性证据)的假设可能被否定。使用退烧药或物理降温的研究也发现了类似的负面结果。
在此基础上更进一步,脓毒性休克患者的诱导性低体温(32-34°C)已被证明会延长急性呼吸衰竭和休克的持续时间,并增加 30 天的死亡率。
纠正体温过低?
由于低体温在脓毒症中很常见,而且与较高的死亡率有关,因此可以主张积极为患者加温。积极的加温可以改善器官灌注、抗生素浓度和免疫系统激活。现有的临床数据很少。在一项德尔菲法调查中,大多数医生都会主动为患者复温。在另一项试验中,体温正常的脓毒性休克患者将接受 1.5°C 的升温,而标准治疗方法则不适用。诱导热疗与更好的预后(28 天存活率和无住院天数)相关,但尽管进行了随机分组,基线特征的不平衡仍阻碍了该试验的进行。还需要进一步研究,以评估低体温和正常体温脓毒症患者的加温情况。目前正在进行一项试点研究,以评估将发热脓毒症患者体温升至 39°C 的可行性(Clinicaltrials.gov - NCT04961151)。
临床医生应该做些什么?
由于 TTM 的疗效尚未得到广泛认可,因此应避免副作用。
对于体温正常的脓毒症,没有数据可以推荐特定的温度范围。
对于高热,只有最高体温(T > 39.5°C)才有理由使用 MTT。扑热息痛是一种常见的低风险药物,而体外降温则具有较高的发冷和皮肤损伤风险。我们建议对体温很高(T > 39.5°C)的患者使用扑热息痛,必要时进行外部降温,以达到 <38.2°C。应不惜一切代价通过镇静或神经肌肉阻滞来避免寒颤,如果无法避免寒颤或出现皮肤损伤,则应停止 TTM。
如果发生低体温脓毒症,应考虑在数小时内逐渐复温,以避免出现血管麻痹。
结论
发热是一种精心调节的机制,其后果各不相同。在脓毒症中,死亡率在很大的温度范围内与血温成反比。然而,现有数据表明,极度低温或高热都是有害的。尽管体温控制有科学依据,但多项试验都未能证明脓毒症患者接受常温诱导治疗的益处。重症监护室通常会控制极高和极低的体温,以减轻患者的不适,但这并没有确切的证据。
来源:Doman. Temperature control in sepsis. Front Med 2023;10:1292468


