Nat Med:替雷利珠单抗联合泽布替尼治疗Richter综合征的2期RT1研究
时间:2023-12-11 16:37:50 热度:37.1℃ 作者:网络
Richter综合征
Richter转化(RT,Richter transformation,也称Richter综合征)是指慢性淋巴细胞白血病(CLL)患者发生侵袭性淋巴瘤,最常见为弥漫性大 B 细胞淋巴瘤 (DLBCL) 或霍奇金淋巴瘤 (HL),CLL患者中 RT 的发生率为2%-10%。RT患者预后极差,R-CHOP等免疫化疗后的客观缓解率(ORR)不足40%,中位总生存期(OS)约为6-8个月。
临床前研究和转化研究表明免疫检查点抑制剂和BTK抑制剂可用于RT患者,可以假设,对于初治或既往接受过不超过一线 RT 靶向治疗的RT 患者,替雷利珠单抗联合泽布替尼可能是诱导缓解的有效策略。Michael Hallek和Barbara Eichhorst教授等开展了一项国际性、研究者发起的2期 RT1 研究,旨在比较替雷利珠单抗联合泽布替尼治疗6个周期的 ORR ,并与预先规定的基准40%进行对比。研究结果近日发表于《Nature Medicine》。

研究方法
RT1 研究是一项研究者发起的前瞻性、开放标签、多中心 II 期研究,纳入既往接受≤1线RT治疗的RT患者。每个治疗周期包括21天,患者在每个周期的第1天接受替雷利珠单抗静脉给药,固定剂量为200mg,从第1天开始,每日两次口服固定剂量的泽布替尼160 mg。诱导期包括6个治疗周期,随后是另外6个周期的巩固期。12个周期后达到缓解或疾病稳定的患者可根据研究者的判断继续接受替雷利珠单抗+泽布替尼维持治疗。
主要终点为诱导治疗结束后(6个周期后)的中期分期时,全分析集(FAS)中接受至少2个周期研究治疗(包括周期3至少给药1次)的患者的ORR。次要终点包括巩固治疗后的ORR、缓解持续时间 (DOR)、无进展生存期 (PFS)、总生存期、至下次治疗时间 (TTNT) 和安全性。
研究结果
患者
共筛选65例患者并入组59例,其中2例患者因死亡(1例)和撤回同意(1例)而未接受研究药物,9例患者在前2个周期内因原发性疾病进展(3例)、死亡(1例)、不良事件(4例)和依从差(1例)而中止研究治疗。根据研究方案,48例接受至少2个周期研究治疗(包括第3周期至少1次给药)的患者组成分析人群(图1)。
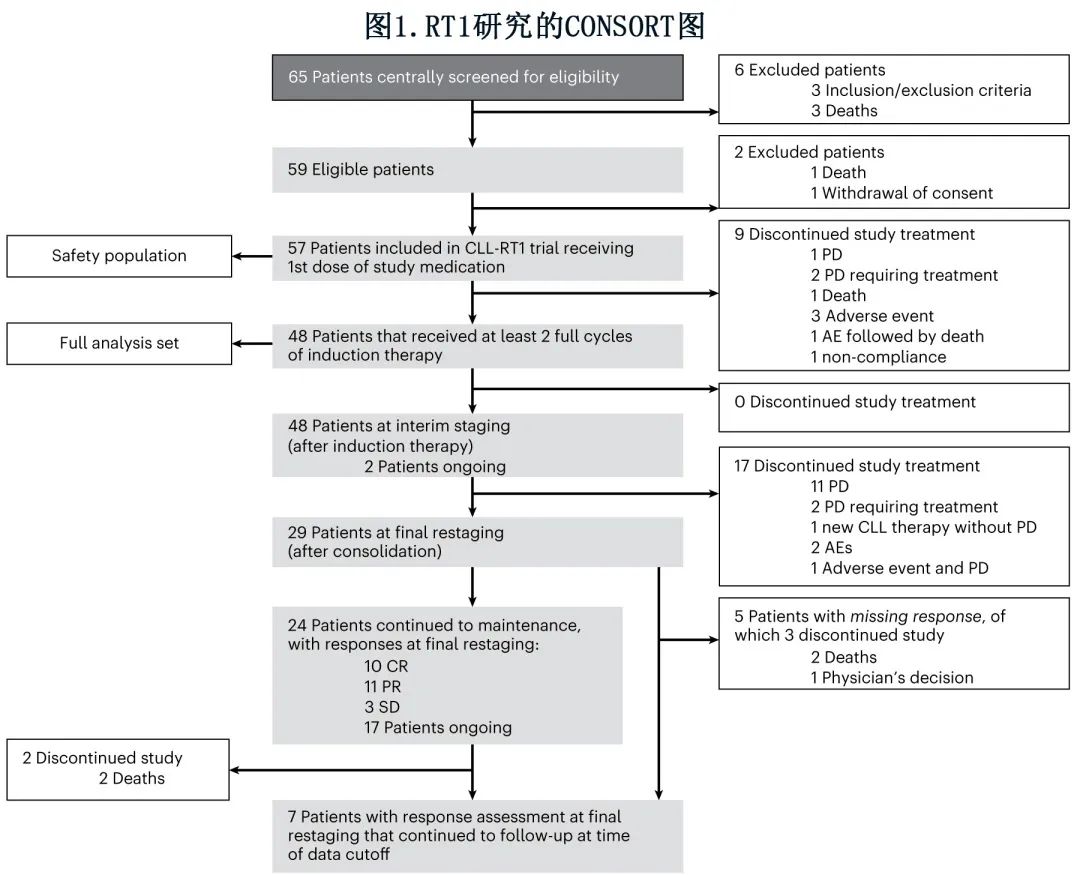
中位年龄为67岁,29例 (60.4%) 患者为男性,19例 (39.6%) 为女性(表1)。22例 (45.8%) 患者的ECOG体能状态为≥1,中位累积疾病评定量表 (CIRS) 评分为4。入组时中位 LDH 为335。16例 (34.8%) 患者携带del(17p)/TP53mut,而29例 (70.7%) 患者为IGHV未突变。总体而言,根据慢性淋巴细胞白血病国际预后指数 (CLL-IPI),25例 (64.1%) 患者为高危或极高危CLL,11例 (28.2%) 为中危,3例 (7.7%) 为低危。16例 (42.1%) 患者检出复杂核型(≥3个畸变)。46例 (95.8%) 患者为DLBCL-RT,2例 (4.2%) 患者为HL-RT。在通过免疫球蛋白重链重排分析评价克隆相关性的26例患者 (54.2%) 中,所有病例均为与 CLL 克隆相关(22例[45.8%)未知)。15例 RT 患者检测了 DLBCL 亚型;14例为GCB亚型,1例为 GCB 亚型。中位 Ki-67 指数为70%。
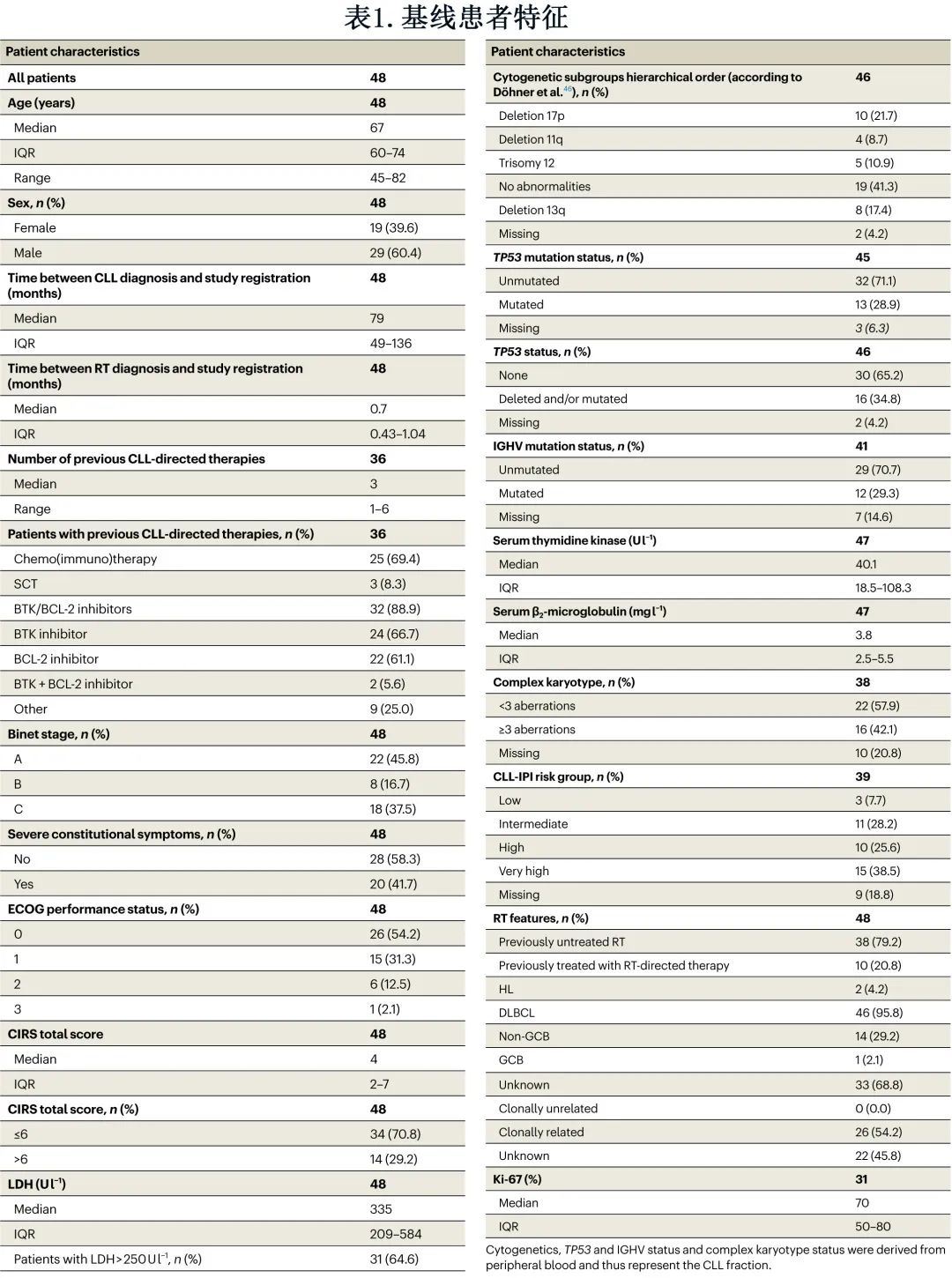
36例 (75.0%) 患者既往接受过 CLL 治疗,包括免疫化疗(CIT;25例患者)和靶向药物(32例患者),以及3例患者既往接受过异基因干细胞移植 (SCT)。在既往接受过靶向治疗的患者中,24例既往接受过 BTK 抑制剂治疗,22例既往接受过 BCL-2 抑制剂治疗,2例既往接受过BTK+BCL-2抑制剂联合治疗(表1)。12例 (25.0%) 患者为初治CLL。10例患者 (20.8%) 既往接受过 RT治疗,包括 R-CHOP 样方案和1例既往伊布替尼治疗;38例 (79.2%) 患者既往未接受过 RT治疗(表1)。
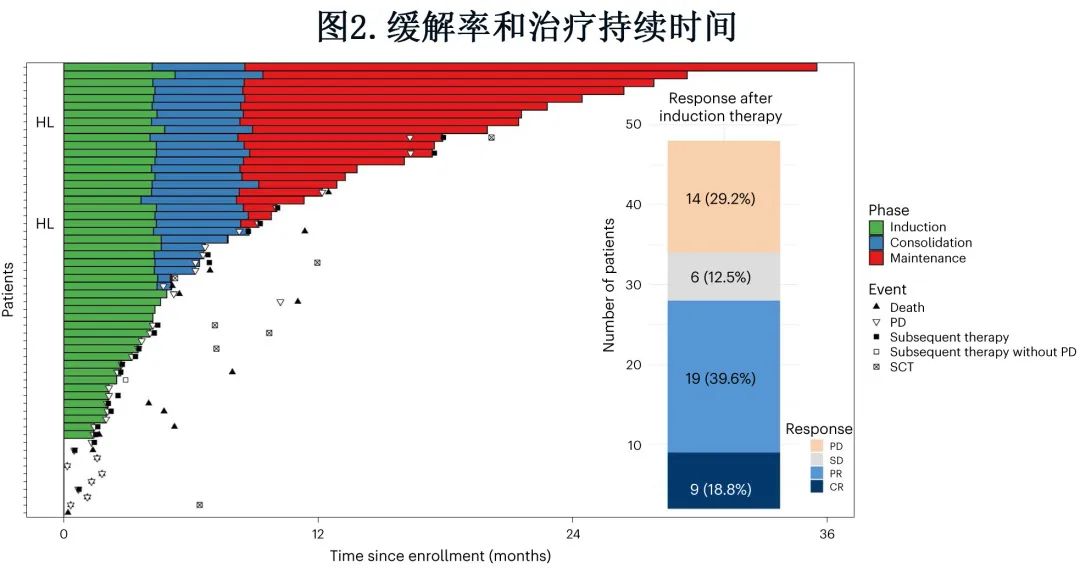
数据截止时,19例患者仍在接受治疗(图2)。总体中位随访时间为13.9个月,仍存活患者的中位随访时间为12.0个月。替雷利珠单抗和泽布替尼的中位治疗周期数分别为9和11。
疗效终点
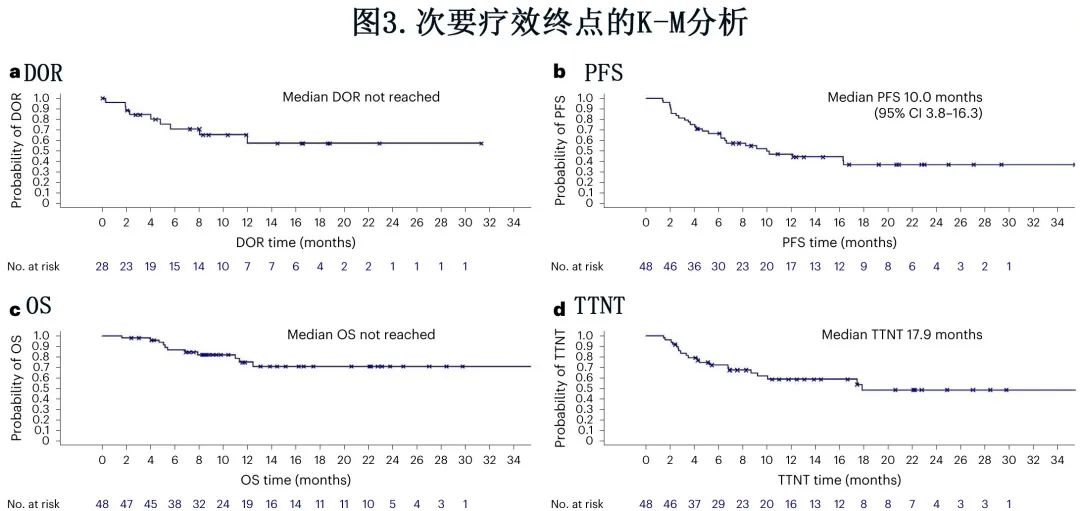
48例患者中有28例诱导治疗后缓解,ORR为58.3%,其中完全缓解9例 (18.8%),部分缓解19例 (39.6%),通过拒绝预定义的40%的无效假设,达到了研究的主要终点 (P=0.008)(图1)。此外6例 (12.5%) 患者疾病稳定,14例 (29.2%) 患者发生疾病进展。根据细化 Lugano 标准评估的 ORR 与根据 iwCLL 标准评估的 ORR 一致。未达到中位DOR;6个月 DOR 率为70.6%(图3a)。中位 PFS 为10个月,12个月PFS率为46.9%(图3b)。中位OS未达到(12个月OS率74.7%,图3c)。所有死亡均与疾病进展相关。中位TTNT(定义为至开始下次治疗的时间,并删失死亡)为17.9个月(12个月 TTNT 率58.5%),当定义为至开始下次治疗或死亡的时间时为12.5个月(12个月 TTNT 率50.2%)(图3d)。48例患者中有3例在12个周期后尚未达到巩固治疗结束,其余45例患者的巩固治疗结束 ORR 为46.7%,包括完全缓解10例 (22.2%),部分缓解11例 (24.4%),疾病稳定3例 (6.7%),疾病进展3例 (6.7%) 和数据缺失18例(40.0%,包括16例在达到巩固治疗结束前停止治疗的患者)。
方案后治疗包括21例 (50.0%) 免疫化疗、7例 (16.7%) BTK/BCL-2抑制和8例 (19.0%) 异基因SCT。SCT 作为巩固治疗在2例部分缓解患者中进行,作为挽救治疗在5例疾病稳定或疾病进展(1例缺失缓解)患者中进行(图2)。
评估的基线临床、血清学或基因组特征均与缓解或无缓解均无显著相关性。在单变量分析中,与 PFS 较短显著相关的因素为存在重度全身症状、ECOG > 0、LDH、胸苷激酶和血清β2-微球蛋白 (>3.5mg/l)。较短的总生存期与Binet C、年龄、严重全身症状、LDH、胸苷激酶和血清β2-微球蛋白 (>3.5mg/l) 相关。较短的 DOR 与存在Binet C、LDH、TP53缺失和/或突变、胸苷激酶和血清β2-微球蛋白相关。
既往未接受过 RT 治疗的患者的 ORR 为57.9%,既往接受过 RT 治疗的患者的 ORR 为60.0%。既往未接受 RT 治疗的患者12个月 PFS 率为43.5%,既往接受 RT 治疗的患者12个月 PFS 率为60.0%。
既往未暴露于 BTK 抑制剂的患者的 ORR 为69.6%,既往接受过 BTK 抑制剂治疗的患者 ORR 为48.0%。既往未接受过 BTK 抑制剂治疗的患者的12个月 PFS 率为58.3%,既往接受过 BTK 抑制剂治疗的患者为37.2%。
事后分析纳入所有59例入组患者,包括未接受至少2个周期研究治疗的患者(ITT人群),结果 ORR 为47.5%;2例 HL 患者均获得了部分缓解。所有入组患者的中位 PFS 为6.7个月,12个月率为39.5%,未达到中位OS(12个月OS率为65.7%),中位 TTNT 为17.9个月(12个月 TTNT 率55.4%)。
安全性终点
安全性分析纳入所有57例接受至少一剂任何研究药物的患者。共有56例 (98.2%) 患者在随访期内至少发生一起≥1级不良事件。随访期内最常见的任何级别不良事件为胃肠系统疾病 (56.1%),包括腹泻 (28.1%) 和恶心 (17.5%);全身性疾病 (52.6%),包括发热 (19.3%)、外周水肿 (17.5%)、水肿 (8.8%) 和疲乏 (8.8%);血液及淋巴系统疾病 (47.4%),包括贫血 (19.3%)。中性粒细胞减少 (21.1%) 和血小板减少 (19.3%) ;感染及侵染类疾病 (78.9%),包括COVID-19(22.8%) 和尿路感染 (21.1%)。

BTK 抑制剂中关注的心脏毒性不常见,包括心绞痛(3级)、心力衰竭(2级)、心血管疾病(1级)、二尖瓣关闭不全(2级)和窦性心动过缓(1级)各1例;未报告房颤发作。3例患者报告1-3级高血压,其中2例有动脉高血压史。5例病例(1-2级)报告血肿,1例接受阿司匹林预防性治疗的患者发生3级脑出血。
检查点抑制剂中关注的潜在免疫相关疾病包括2例甲状腺疾病(甲状腺功能减退,2级)、发热(12例,1-3级)和肝脏值升高(5例,1例高胆红素血症和4例转氨酶炎性升高,1-4级)。
总体而言,安全性人群中报告了3起5级不良事件,所有事件均与致死性脓毒症相关。
总结
RT1研究入组59例Richter综合征患者,其中48例患者接受至少2个周期的治疗,并根据研究方案组成分析人群。中位随访时间为13.9个月,中位年龄为67岁。10例患者 (20.8%) 既往接受过 RT 治疗。48例患者中共有28例对诱导治疗有反应,总缓解率为58.3%,包括9例 (18.8%) 完全缓解和19例 (39.6%) 部分缓解,通过拒绝预定义的40%的无效假设,达到研究的主要终点 (P=0.008)。未达到中位缓解持续时间,中位无进展生存期为10个月。未达到中位总生存期,12个月总生存率为74.7%。最常见的不良事件为感染 (18.0%)、胃肠道疾病 (13.0%) 和血液学毒性 (11.4%)。
总的来说,替雷利珠单抗联合泽布替尼是Richter综合征患者一种有效且耐受性良好的治疗策略。考虑到Richter综合征的不良预后,RT1研究中的缓解率和1年总生存率令人鼓舞。
参考文献
Al-Sawaf O,et al. Tislelizumab plus zanubrutinib for Richter transformation: the phase 2 RT1 trial.Nat Med . 2023 Dec 9. doi: 10.1038/s41591-023-02722-9.


