国科温研院汤思成、昝兴杰《AM》:通过超小聚合物胶束增强贝伐珠单抗眼用给药的抗血管生成疗效
时间:2024-06-08 06:01:56 热度:37.1℃ 作者:网络
【背景介绍】
视网膜病理性新生血管是导致多种缺血性和炎症性视网膜疾病(如糖尿病性黄斑水肿和新生儿视网膜病变、湿性黄斑变性晚期)视力损害的关键原因。这一过程主要是由血管内皮生长因子(VEGF)的升高所驱动。VEGF不仅促进血管生成,还会增加血管通透性,从而导致视网膜结构和功能的病理性改变。抗VEGF药物是目前治疗方案的金标准,临床上主要依赖于玻璃体腔内注射康柏西普、雷珠单抗或贝伐珠单抗(Beva)来抑制新生血管。然而,反复的玻璃体腔内注射存在眼内炎、视网膜脱离和患者不依从性等风险。因此,探索提高眼用药物递送效率的替代策略,实现从诊所到家庭的给药范式转变备受关注。然而眼球复杂的生理障碍极大地挑战了外源化合物的传递,尤其是亲水生物制剂如蛋白质。药物经角膜和结膜途径到达视网膜部位均面临着显著的障碍。其中经角膜途径被角膜上皮、内皮的紧密连接所阻碍,同时角膜多层结构的亲疏水性变化也进一步限制了渗透。独立的结膜通路,包括结膜、巩膜和脉络膜,也会遇到结膜紧密连接和巩膜致密胶原蛋白基质等障碍。因此,这两条途径都对药物有效传递至视网膜构成了重大障碍。克服这些障碍需要创新型给药平台,这是转变视网膜疾病治疗范式的关键一步。
日前,国科温州研究院的汤思成研究员与昝兴杰研究员团队及其合作者,开发了一种基于梳状聚合物的超小聚合物胶束纳米药物制剂,用于增强贝伐珠单抗在眼表给药达到眼底抗血管生成的效果。相关工作以“Enhanced Ocular Delivery of Beva via Ultra-Small Polymeric Micelles for Noninvasive Anti-VEGF Therapy”发表在《Adv. Mater.》。

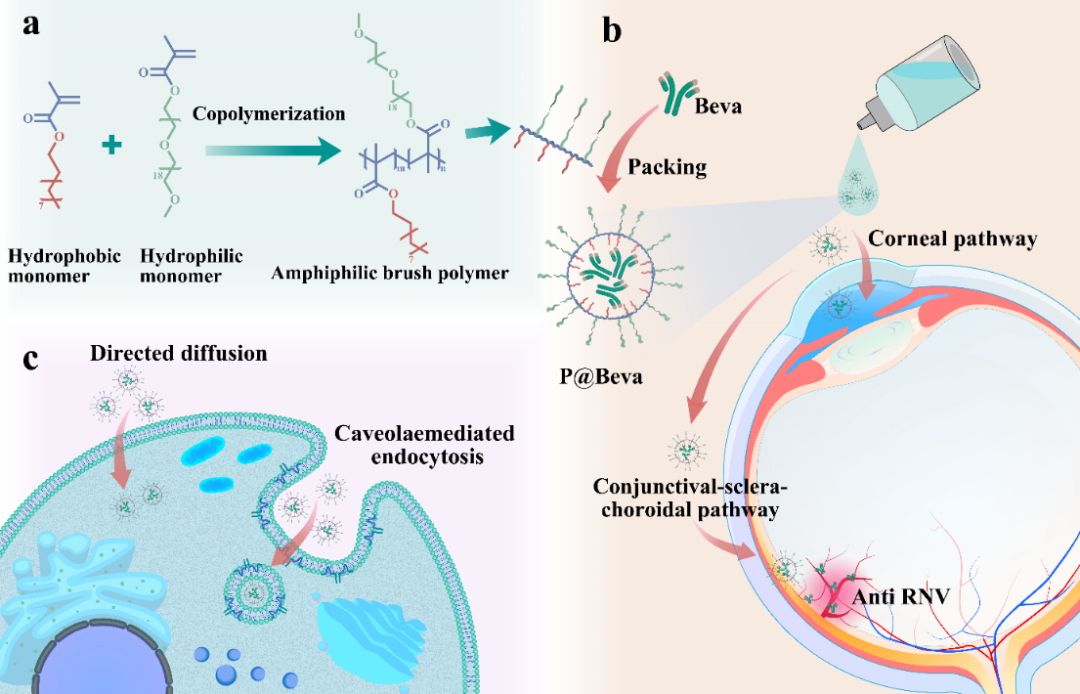
图1. 超小聚合物纳米胶束递送Beva单抗治疗眼底新生血管示意图。
【研究内容】
为解决眼表给药难以到达眼底的挑战,该研究策略性地设计了一种超小的两亲性聚合物胶束,用于包封抗VEGF单克隆抗体贝伐珠单抗(Beva),并研究了其在眼用给药中的性能表现。高度分支化的聚合物结构特征赋予了它们密集的侧链阵列,促进了强烈的分子间相互作用,推动了在水环境中自组装形成紧凑的胶束结构。该结构聚合物包封抗VEGF单克隆抗体贝伐珠单抗,形成了超小聚合物胶束。
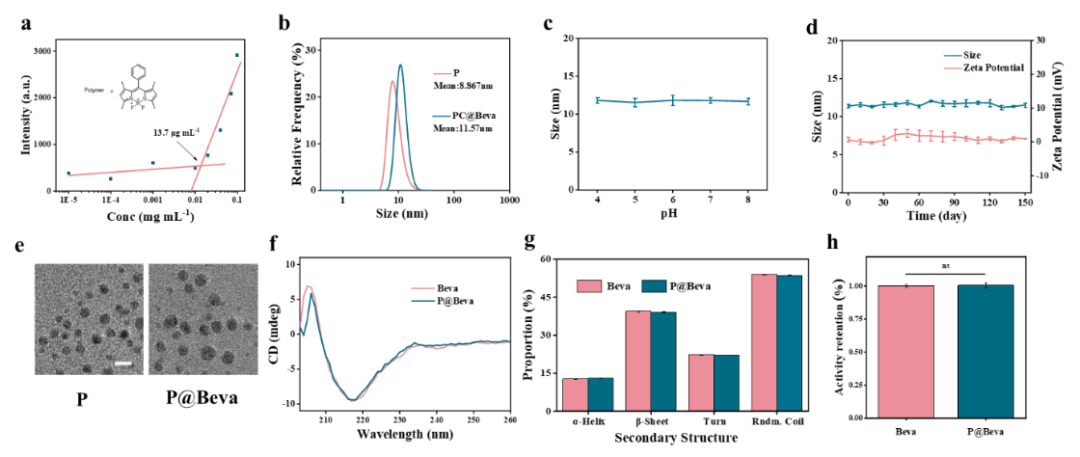
图2. 纳米胶束的性质表征。
表征发现这种聚合物在PBS中的临界胶束浓度为13.7μg/mL,能够在这一浓度以上高效自组装形成尺寸约为8.86纳米的超小聚合物胶束(P),并可以高效包封贝伐珠单抗形成粒径约为11.57纳米的载药胶束P@Beva,包封率高达86.5%,载药量为14.4%。圆二色谱分析其二级结构,结果显示包封前后Beva的β-折叠和无规卷曲的比例基本保持不变,说明包封过程未破坏蛋白质二级结构。活性测定也证实P@Beva与游离Beva活性无显著差异。P@Beva表面电荷为+0.18mV,接近中性。这种超小尺寸和中性电荷有利于细胞内吸收和组织渗透。储存1年后尺寸和表面电荷均保持稳定,显示出优异的胶体稳定性。
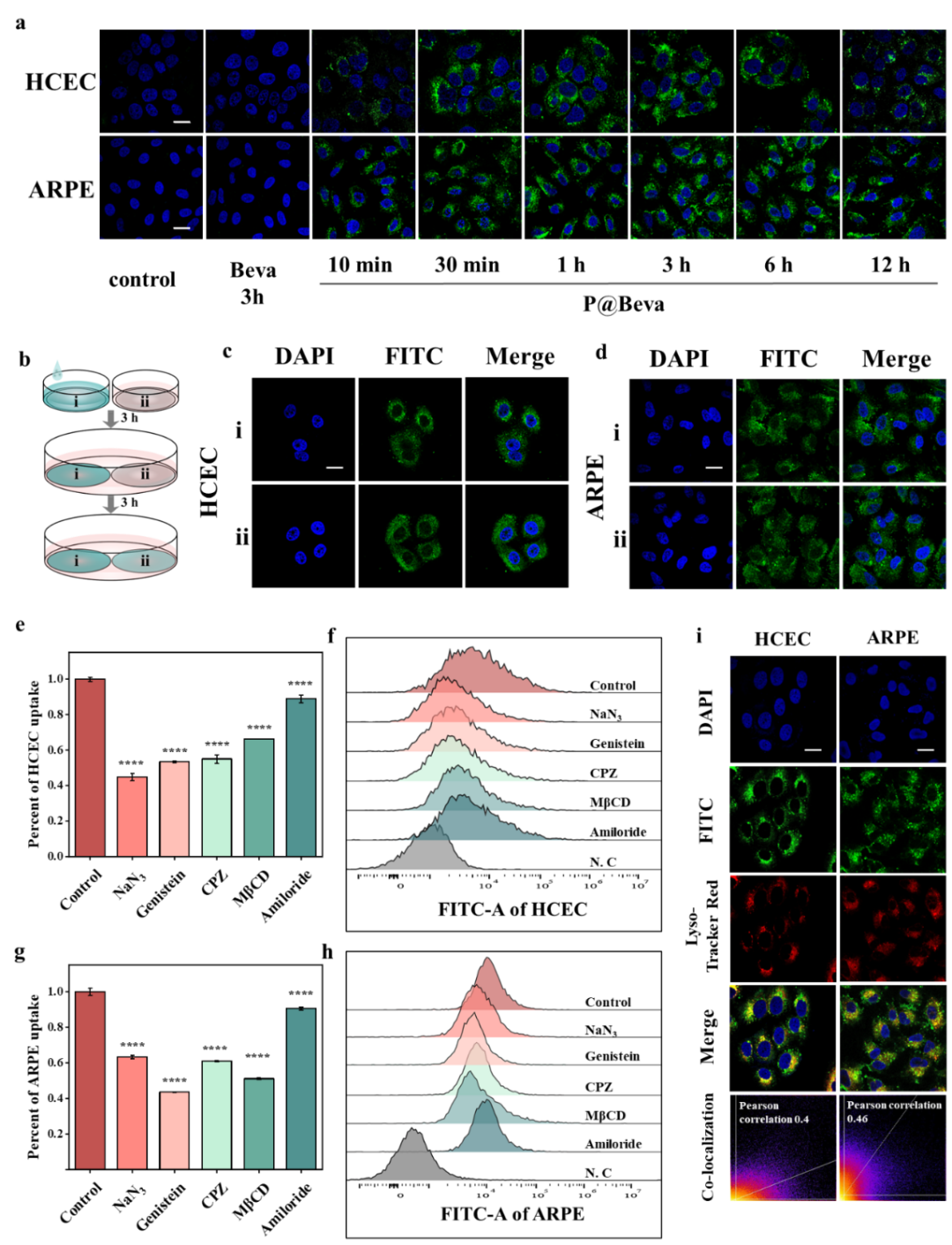
图3. 纳米胶束增强Beva单抗在眼部细胞中的内吞以及转胞吞能力,以及内吞途径探究。
将游离Beva或当量P@Beva分别作用于角膜上皮细胞和视网膜色素上皮细胞。免疫荧光结果显示游离Beva在3小时内几乎无法被上述细胞内化,而P@Beva则在10分钟内即可被快速内化,并在1小时内明显积累于细胞内,且在12小时后仍能检测到细胞内信号。通过胞间转运实验证实,P@Beva可通过跨细胞途径在上皮和色素上皮细胞间转运递送Beva。进一步通过多种内吞途径抑制实验发现,P@Beva可通过多种途径实现细胞内化,其中直接扩散途径和经小窝蛋白介导的入胞途径可不经过溶酶体,避免了蛋白类药物经溶酶体途径降解,从而保证递送蛋白质的活性保留。
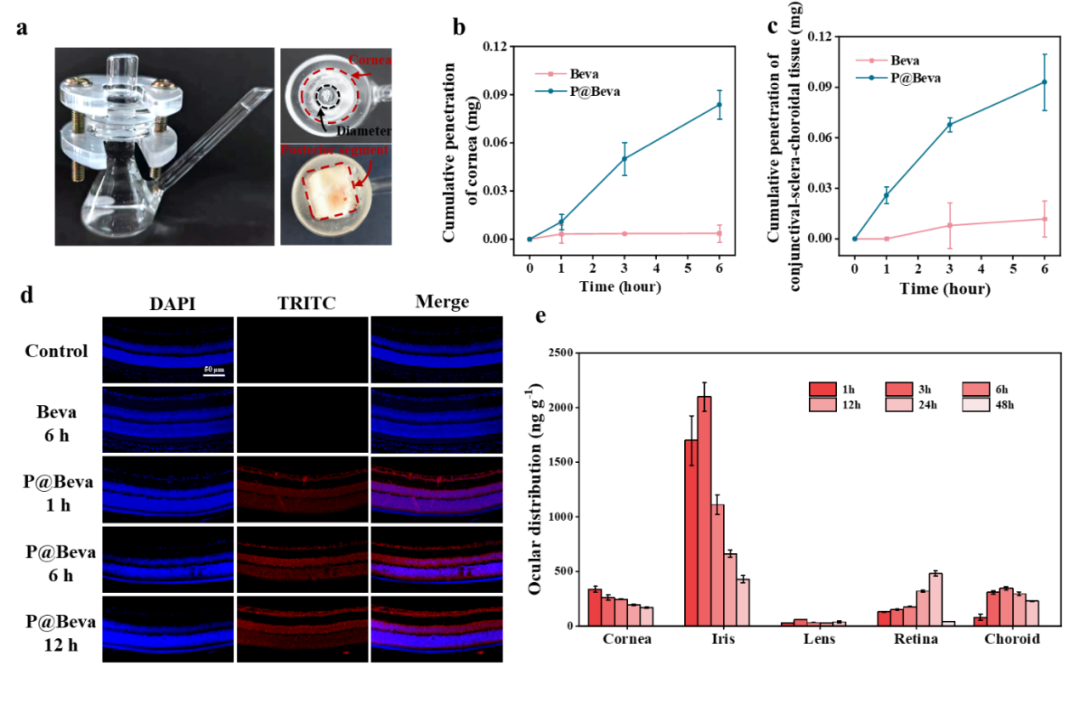
图4. 负载Beva单抗的纳米胶束在离体组织中的渗透以及在小鼠眼球中的药代动力学测试。
采用Franz扩散池并分别装载离体兔眼角膜和结膜-巩膜-脉络膜组织,通过受体室溶液的吸光度检测透过组织的Beva浓度。结果显示在6小时内,P@Beva的角膜透过率(约8%)较游离Beva提高了23倍,结膜-巩膜-脉络膜组织透过率(约9%)较游离Beva提高了7.9倍。而单独给予游离Beva,两种组织中的累积透过量均不足1%。进一步在小鼠体内检测,免疫荧光染色和ELISA定量结果一致显示,滴眼P@Beva 1小时即可检测到药物进入视网膜各层,浓度持续增加并在24小时达到479.6±23.7ng/g的平稳水平,远高于游离Beva组。这一切都证实了该纳米胶束系统能够显著增强药物透过眼部生理屏障并有效递送至眼后视网膜。
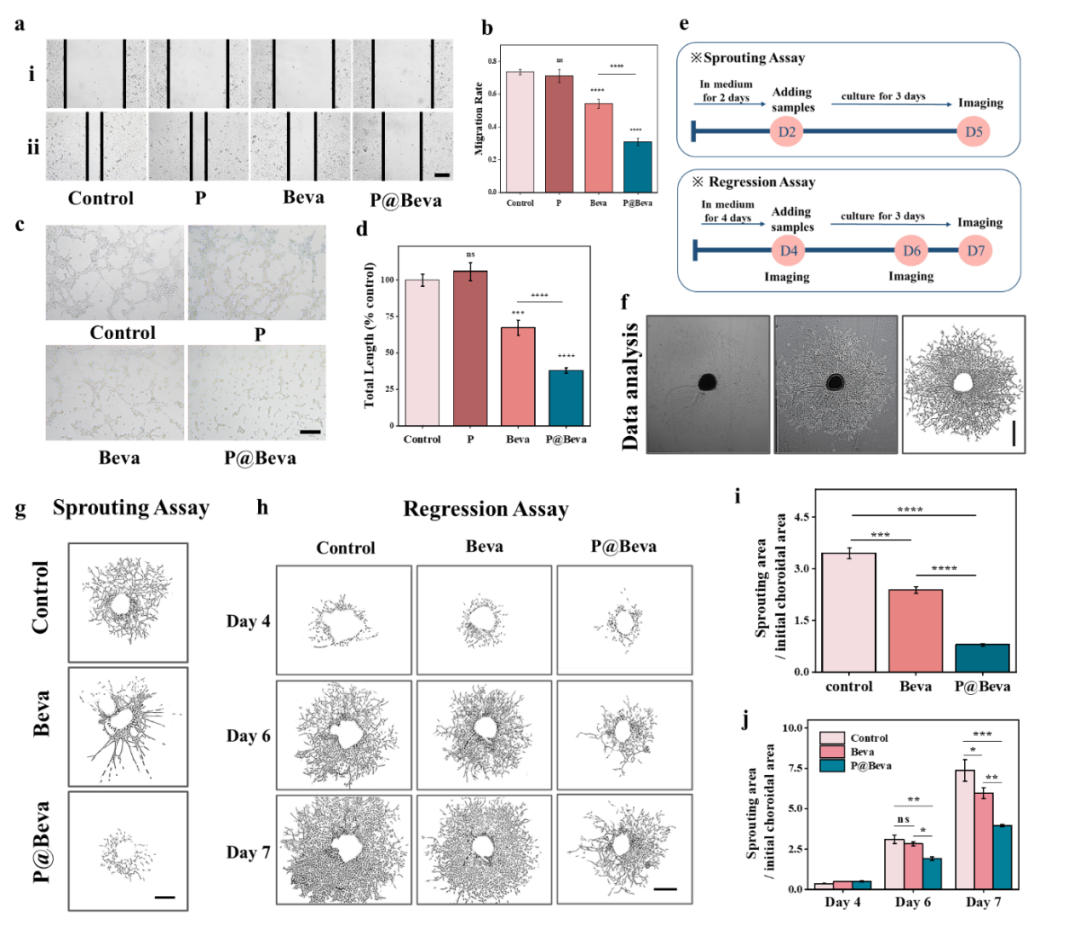
图5. 负载Beva单抗的纳米胶束功能性探究。
在血管内皮细胞系HUVEC中评估了P@Beva的抗血管生成活性。与对照组相比,单独给予游离Beva可抑制HUVEC的迁移率至54.3%,但P@Beva能将其进一步降低至30.9%。在管腔形成实验中,Beva使总支管长度降至67%,而P@Beva则将其降至37.9%。进一步在离体脉络膜发芽实验中,Beva可使出芽面积/初始面积的比值降至2.38,但P@Beva则可将比值降至0.79。在脉络膜回退实验中,7天时Beva使新生血管面积/初始面积比值降至5.96,而P@Beva则可将其降至3.94。所有结果均远好于游离Beva,说明包封于该纳米胶束后,Beva在细胞内递送被增强,使抗血管生成功能明显增强。
为评估P@Beva作为滴眼液的安全性,研究人员对小鼠双眼持续给药1个月,两次/天。裂隙灯检查显示P@Beva组小鼠角膜无混浊点染,与对照组一致。免疫荧光结果也显示P@Beva组小鼠角膜上皮连接蛋白Occludin表达水平与对照组无显著差异,说明上皮屏障功能未受损。角膜内皮胎盘蓝-茜素红双染和视网膜电生理检查结果也未见异常。HE染色显示P@Beva长期滴眼后视网膜层次清晰,形态学无异常及炎症反应,进一步证实了该纳米胶束系统具有良好的生物相容性和安全性。
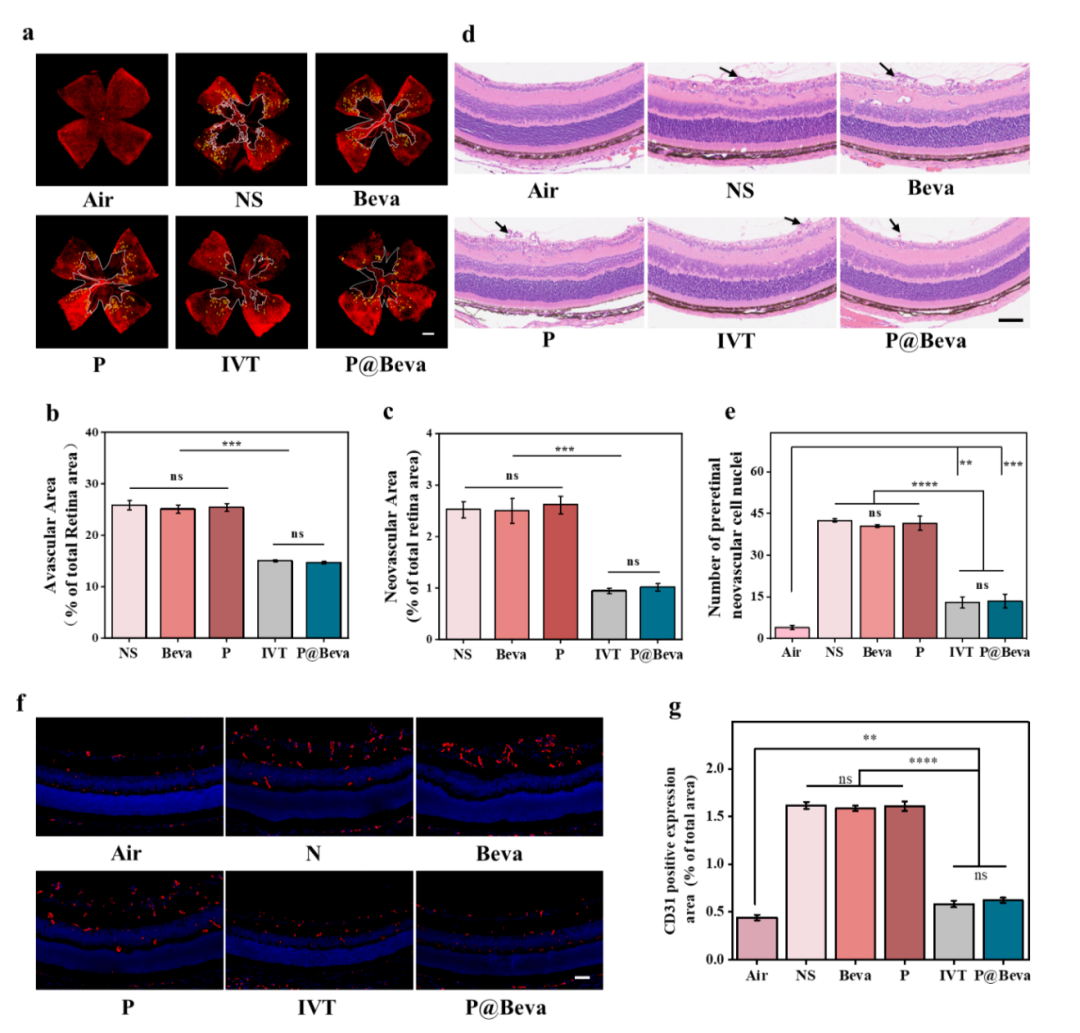
6. 负载Beva单抗的纳米胶束对OIR小鼠眼底新生血管的治疗情况展示。
最后采用C57小鼠构建经典氧诱导新生血管性视网膜病变(OIR)模型评估P@Beva的疗效。在小鼠P12从75%高压氧舱中移至常氧环境(含氧量21%)时,将其分为空白对照(NS)、Beva滴眼液组(5mg/mL)、空载胶束组(P)、载药胶束组P@Beva(5mg/mL,等当量Beva)和玻璃体内注射Beva(IVT)五组,滴眼液组小鼠双眼连续5天给予相应滴眼液治疗(两次/天)。结果显示,与NS、Beva、P组相比,P@Beva组小鼠视网膜缺氧区面积降低至14.69%,与IVT组(15.06%)无显著差异;新生血管区面积也显着降至1.02%,与IVT(0.96%)无显著差异。HE染色结果显示P@Beva组突破视网膜内界膜的细胞核数(13.5个)与IVT组(13个)基本一致,两组视网膜组织的形态结构也最接近正常组。CD31阳性表达面积也显示P@Beva组(0.62%)与IVT组(0.58%)抑制新生血管的作用。
【总结】
该研究工作提出了一种基于梳状聚合物的超小蛋白质纳米载体平台, 有望代替具有创伤的玻璃体内注射疗程,采用无创滴眼治疗方式,具有为眼后部疾病提供新的治疗方式的潜力。此种简化可能扩大患者可及性和依从性,同时减轻医疗系统的负担。这种递药方式为从诊所转变为家庭给药治疗、通过简化给药方式为有视力缺陷的新生血管性视网膜疾病转变治疗做出了贡献。
【课题组介绍】
汤思成,国科温州研究院昝兴杰课题组,岗位研究员。2013年至今共发表论文33篇,其中中科院一区17篇,包括JACS、Advanced Materials、Nature Communications、Advanced Science、ACS Sensors、ACS Macro Letters等。主要研究方向包括:(1)两亲性纳米胶束递送蛋白类药物的应用;(2)功能性荧光分子在诊疗一体化方面的应用。
昝兴杰,高分子材料学博士、研究员、博士生导师。现任职于国科温州研究院,生物界面课题组负责人。涉及的研究领域包括生物材料学,细胞生物学,组织工程,蛋白质工程和基因工程等。主持国家、省部、市厅级项目10余项,总经费约1200万元。曾获得德国“高级洪堡学者”、第十四批国家“国家高层次人才计划-青年项目”、“温州市580海外精英人才计划”、“台州市500创业人才计划”等项目的支持。
课题组网站:
https://www.x-mol.com/groups/WIUCAS-XJ_Zan
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202314126?af=R


