近10万例样本解析BRAF融合,跨越52种癌症类型,泛癌靶药治疗新突破口
时间:2024-07-15 18:00:35 热度:37.1℃ 作者:网络

尽管BRAF融合越来越多地在标准的多基因二代测序panels中检出,但很少有报道探讨其结构及其对临床病程的影响。研究者收集了通过97,024个样本的基因分型方案确定的BRAF融合阳性癌症患者的数据。研究者对融合进行了特征分析,并回顾了致癌潜能(框内状态、非BRAF伴侣基因、完整的BRAF激酶106结构域)。
研究者在212例患者中发现241个BRAF融合阳性肿瘤,82个独特的5 '融合伴侣,来自52种组织学类型。39个融合伴侣既往未被报道,61个曾被发现。BRAF融合发生率在毛细胞星形细胞瘤、神经节瘤、低级别神经上皮肿瘤和胰腺腺泡细胞癌中富集。来自多个组织学类型的24例患者接受了靶向MAPK治疗,其中20例根据RECIST可评估。最佳疗效是部分缓解(N=2),疾病稳定(N=11)和疾病进展(N=7)。MEK + BRAF抑制剂治疗的中位时间为1个月([N=11],范围为0-18个月),MEK抑制剂治疗的中位时间为8个月([N=14],范围为1-26个月)。9例患者持续治疗超过6个月,其中包括毛细胞星形细胞瘤6例,Erdheim-Chester病1例,脑室外神经细胞瘤1例,黑色素瘤1例。15例患者有获得性BRAF融合。
BRAF融合越来越多地在标准的多基因二代测序panels中检出,且在各种组织学中均可发现,代表了一个新兴的可干预靶点。在本文中,研究者报告了迄今为止描述BRAF融合的结构和对临床病程的影响的最大研究。BRAF融合有一系列不同的融合伴侣。研究者观察到对MAPK疗法的持久缓解,特别是在毛细胞型星形细胞瘤中。此外,研究者发现BRAF融合是许多癌症的获得性耐药机制,这强调了进展后测序的必要性。
研究背景
BRAF基因位于染色体7q34,编码丝氨酸/苏氨酸蛋白激酶,该蛋白激酶在丝裂原活化蛋白激酶(MAPK)信号通路中起关键作用。约4-15%的癌症携带激活性BRAF变异,其中在黑色素瘤、结直肠癌、甲状腺癌和肺癌中富集。
BRAF变异有三类。I类BRAF V600突变是最常见的,独立于RAS,并且作为激酶单体具有高激酶活性。II类变异以二聚体的形式发挥作用,独立于RAS,具有中至高激酶活性。III类变异以RAS依赖、异源二聚体依赖的方式起作用,并且BRAF激酶活性低。在>100,000肿瘤分析中,BRAF变异的发生率为:I类(2%的癌症,62%的BRAF变异)、II类(1%的癌症,17%的BRAF变异)和III类(1%的癌症,18%的BRAF变异)。
开发靶向BRAF疗法的研究已使多个BRAF抑制剂单独使用或与MEK或EGFR抑制剂联合使用获得批准。这些药物对I类突变患者有效,但获益不持久。此外,目前尚无针对耐药性的靶向BRAF治疗方案。治疗II类和III类突变的药物代表了尚未满足的需求。在迄今最大的泛癌症分析(N=55)中,BRAF融合是在0.3%的癌症中发现的II类变异。此外,越来越多的证据表明,在包括肺癌和结直肠癌在内的多种组织学中,BRAF融合代表了对靶向治疗耐药的获得性和潜在可干预的机制。与BRAF V600突变不同,BRAF融合通过去除自身抑制的N末端区域激活MAPK通路,从而导致BRAF蛋白的组成性二聚化,从而可能减少对融合伴侣的依赖。关于携带BRAF融合的患者对靶向MAPK治疗的应答数据有限,但这些药物处于早期临床研究中。在临床前模型中,BRAF融合对RAF抑制剂(即维莫非尼)不敏感,但对较新的RAF抑制剂BGB659和PLX8394敏感。
在本研究中,研究者在一项前瞻性基因组测序工作中,对在纪念斯隆·凯特琳癌症中心(MSK)检出的所有BRAF融合进行了临床和基因组分析。
研究结果
从2014年1月至2022年11月,来自69,337例不同患者的97,024个样本接受了NGS检测,其中212例携带致癌BRAF融合。其中,195例为原发BRAF融合,17例是在靶向治疗后检测到。在17例患者中,有15例证实为获得性BRAF融合。另外2例患者在检测到BRAF融合之前未进行NGS检测。
原发BRAF融合:
所有组织学类型的中位年龄为53岁(范围:1-89岁),男性占53%。原发BRAF融合的发生率<1%(195/69,337)。在52种不同的成人和儿童肿瘤类型中观察到BRAF融合,不同的癌症类型的发生率不同(图1)。BRAF融合最富集的肿瘤类型是毛细胞星形细胞瘤(N=29, 发生率为56%)。BRAF融合见于≥5%的神经节细胞胶质瘤、低级别和高级别神经上皮肿瘤、多形性黄色星形细胞瘤、纤维肉瘤、胰腺神经内分泌癌和胰腺腺泡细胞癌患者。值得注意的是,神经节瘤、低级别和高级别神经上皮肿瘤、多形性黄色星形细胞瘤、胰腺神经内分泌癌和纤维肉瘤的患者不到20例。在其余的组织学中,BRAF融合的发生率≤5%。
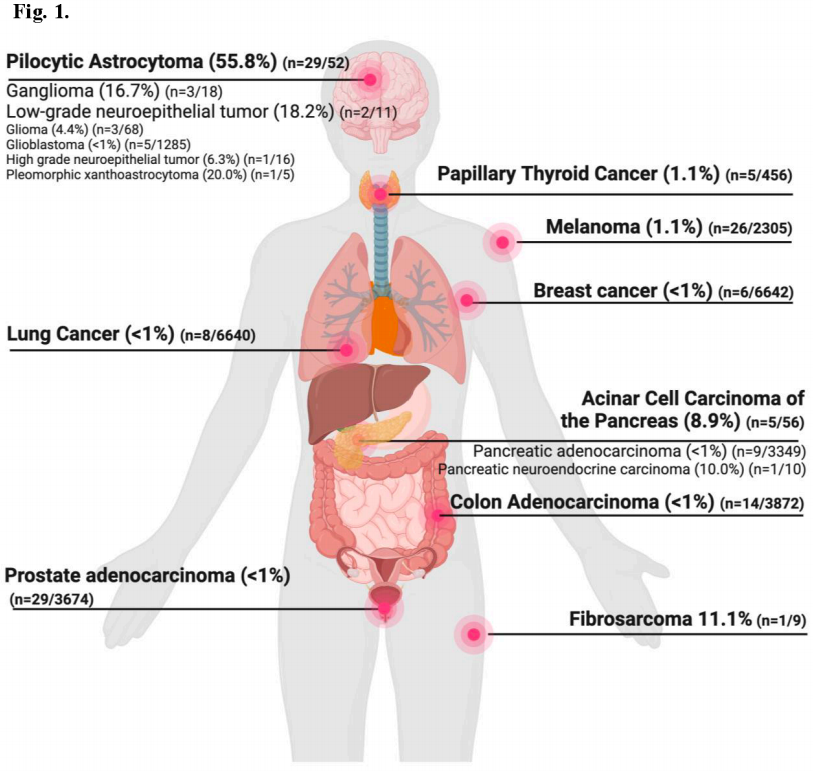
图1
原发BRAF融合的基因组分析:
基于DNA的肿瘤NGS检测到180个原发BRAF融合,基于RNA的肿瘤NGS检测到12个原发BRAF融合,基于ctDNA的NGS检测到3个原发BRAF融合。在原发BRAF融合中,研究者发现了75个独特的5 '融合伴侣,其中36个是新的(图2A-B)。新型BRAF融合的外显子组成见图2B。5 '伴侣中有很大一部分只被检测过一次(“不频发”,N=54,28%)(图3A,x轴上的橙色框)。最常见的上游融合伴侣是KIAA1549(N=48,25%)、SND1(N=20,10%)、AGK(N=12,6%)、MKRN1(N=9,5%)和TRIM24(N=9,5%)(图3A)。
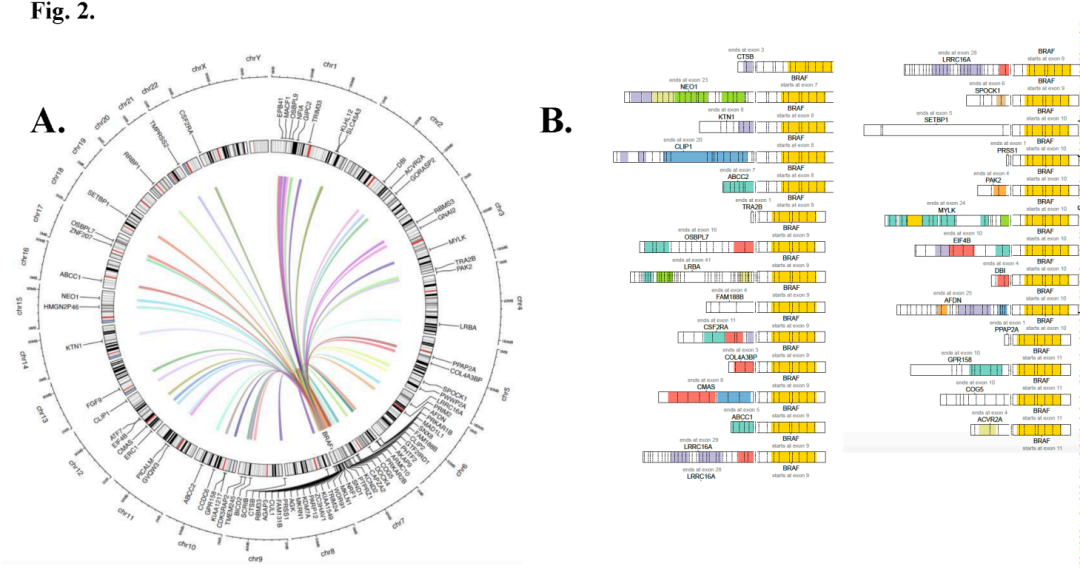
图2
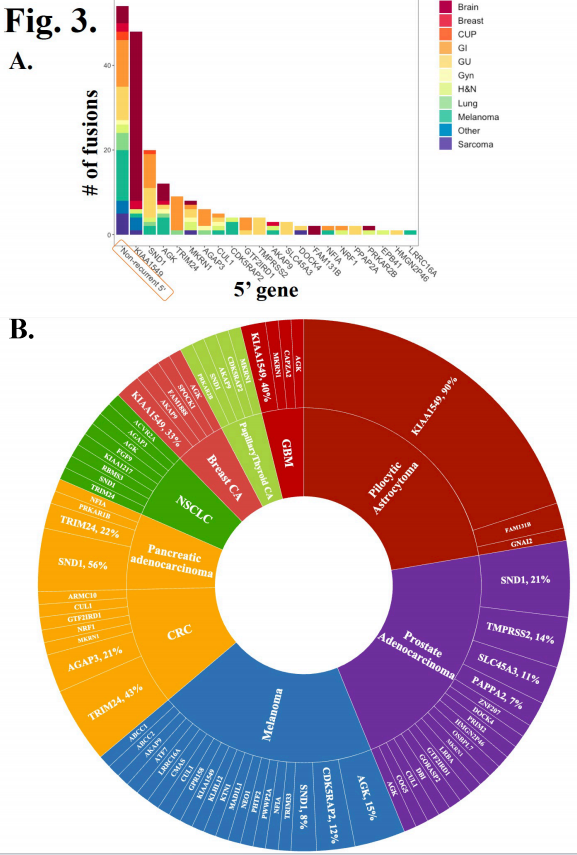
图3
图3B显示了至少5例患者根据肿瘤组织学类型分层的5 '融合伴侣。几乎所有毛细胞型星形细胞瘤的患者携带BRAF-KIAA1549(90%,N=26/29)。最常见的5 '融合伴侣在前列腺腺癌中为SND1 (21%,N=6)、TMPRSS2 (14%,N=4)和SLC45A3 (11%,N=3),在黑色素瘤中为AGK (15%,N=4)和CDK5RAP2 (12%,N=3),在结直肠癌中为TRIM24 (43%,N=6)和AGAP3 (21%,N=3),在胰腺癌中为SND1 (56%,N=5)和TRIM24 (22%,N= 2)(图3B)。
在所有组织学中,BRAF融合最常与TP53突变(22%)、TERT突变(18%)、CDKN2A缺失(14%)和CDKN2B缺失(12%)共变异。毛细胞型星形细胞瘤患者很少发生共变异,在毛细胞型星形细胞瘤队列中,未发生>5%频率的共变异。TERT突变常见于黑色素瘤(64%)、甲状腺癌(73%)和胶质瘤(11%)。结直肠癌通常发生共变异,频率>30%的包括RNF43(64%)、TP53(57%)、KMT2D(43%)、MSH3(42%)、ARID1A(36%)和INPPL1(33%)。在所有组织学类型中,BRAF融合与MAPK通路的其他变异是互斥的。
靶向MAPK通路的治疗:
24例原发BRAF融合患者接受了靶向MAPK通路的治疗,包括多种组织学、治疗线和联合治疗。最常见的组织学类型为毛细胞型星形细胞瘤(21%,N=5)。本试验采用了多种治疗方法:58%的患者采用MEK抑制剂单独治疗,46%采用BRAF和MEK抑制剂联合治疗,4%采用ERK抑制剂治疗。既往治疗的中位线数为2(范围:0-6)。
这一异质性人群的缓解情况广泛(图4A),最佳缓解情况包括部分缓解(PR,N=2)、疾病稳定(SD,N=11)和疾病进展(PD,N=7)(图4B)。4例患者无法评估基于RECIST的最佳疗效。1例患者无可评估的疾病,2例患者在首次扫描前已出现临床PD,1例患者在首次扫描前因不良反应停止治疗。联合MEK和BRAF抑制剂(N=11)治疗的中位时间为1个月(范围:0-18个月),MEK抑制剂(N=9)治疗的中位时间为8个月(范围:1-26个月)。1例结肠癌患者接受ERK抑制剂治疗1个月。
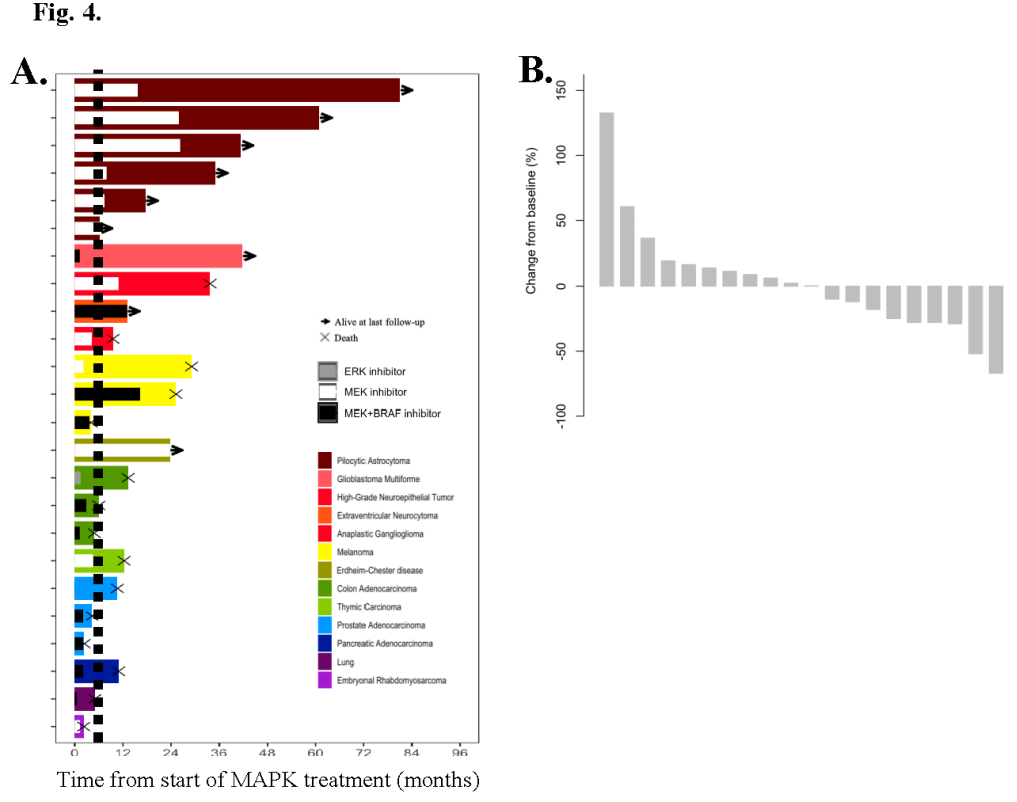
图4
在2例患者中观察到证实的RECIST PRs。1例接受考比替尼治疗的Erdheim-Chester病患者达到了67%的肿瘤缩小(作为最佳应答),肺结节、胰腺肿块和胃肿块减少。尽管Erdheim-Chester病患者因皮疹和水肿降低了2次剂量,但仍在接受治疗22+个月。第二个经证实的缓解发生于1例接受司美替尼治疗的高级别神经上皮肿瘤患者,该患者的原发性颞叶病灶与基线相比减少了52%,但在治疗10个月后出现进展。
9例患者治疗>6个月,包括所有毛细胞型星形细胞瘤(6/6)。所有毛细胞星形细胞瘤患者均接受了MEK抑制剂治疗,其中4例接受了司美替尼治疗,2例接受了曲美替尼治疗。中位治疗时间11个月(范围:6-26个月)。中位随访时间38个月(范围:6-81个月)。在毛细胞星形细胞瘤的6例患者中,4例使用MEK抑制剂后疾病缩小。
在接受靶向MAPK通路治疗的患者中,71%发生了任何级别的治疗相关不良事件,其中8例患者需要维持剂量,4例患者需要降低剂量,4例患者因毒性停止治疗。最常见的不良反应为皮疹(29%,N=7)。
获得性BRAF融合:
15例患者在靶向治疗后获得BRAF融合[EGFR突变型肺腺癌(N=10)、BRAF V600E突变型肺腺癌(N=1)、结直肠癌(N=1)、BRAF V600E突变型甲状腺乳头状癌(N=1)、FGFR3融合阳性膀胱癌(N=1)、NTRK1融合阳性肺腺癌(N=1)](图5A)。中位年龄为57岁(范围:37-79岁),大多数患者为女性,从不吸烟。在EGFR突变型肺癌患者中,8例有EGFR外显子19缺失,1例有EGFR外显子21 L858R突变,1例有EGFR外显子18 G719C和EGFR外显子21 L861Q突变。TP53是最常见的共变异。
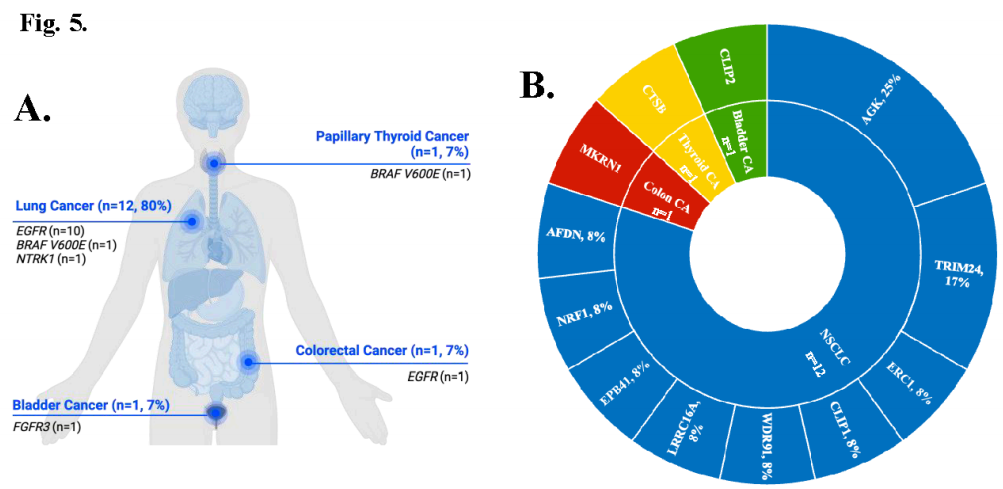
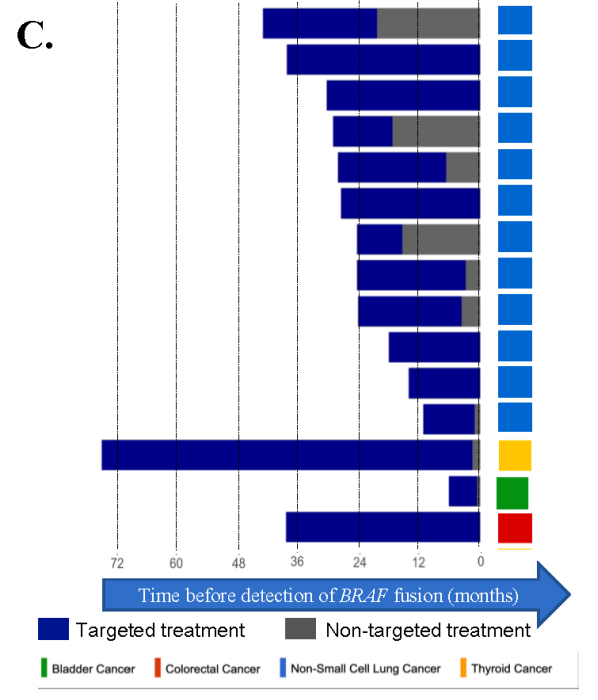
图5
最常见的5 '融合伴侣AGK(N=3)存在于25%的肺腺癌患者中,其中67%(N=2)为EGFR突变型肺腺癌(图5B)。TRIM24-BRAF融合的2例患者均为EGFR突变型肺腺癌。其余均为非频发的5 '融合伴侣。
对于EGFR突变型肺腺癌患者,从开始靶向治疗到BRAF融合检测的中位时间为23个月(范围:9-37个月)(图5C)。既往EGFR TKIs包括奥希替尼(N=9)、阿法替尼(N=2)和厄洛替尼(N=3)。2例患者接受多种EGFR TKIs治疗。2例患者在耐药时接受EGFR TKI联合曲美替尼治疗。一名患者继续使用曲美替尼和厄洛替尼12个月,唯一的副作用是1级皮疹。值得注意的是,该患者还携带原发BRAF V600E突变。第二例接受曲美替尼和厄洛替尼治疗的患者分别在2个月后观察到疾病进展。所有患者均未出现3级或更高级别的毒性。
讨 论
BRAF融合是一个潜在的治疗靶点。本系列代表了已报道的最大和最分子多样性BRAF融合阳性癌症系列。研究者发现,BRAF融合发生于0.3%的研究患者,这些患者涉及52种不同的组织学类型,包括原发性和获得性BRAF融合。BRAF融合在毛细胞星形细胞瘤、神经节瘤、低级别神经上皮肿瘤和胰腺腺泡细胞癌中富集。
值得注意的是,研究者发现在不同的癌症类型中,BRAF融合具有非常多样化的融合伴侣。患者来源的异种移植模型显示BRAF融合伴侣影响功能、治疗反应和生长率。因此,BRAF融合的多样性为开发靶向治疗提供了挑战。
本研究发现了82个不同的5 '融合伴侣,其中几乎一半(N=39,48%)以前没有被报道过。对于原发和获得性BRAF融合,最常见的5 '融合伙伴是KIAA1549(23%)、SND1(9%)、AGK(8%)和TRIM24 (5%);然而,29%为非频发。这与其他致癌性融合不同,其他致癌性融合以一个伴侣为主,并与受体酪氨酸激酶融合(例如,ALK的伴侣EML4,ROS1的CD74,NRG1的CD74)。这可能是因为与许多其他融合不同,BRAF融合不需要5 '基因伴侣内的卷曲螺旋结构域来二聚化并启动下游磷酸化。BRAF融合的基因多样性凸显了伴侣不可知诊断策略的必要性。既往已经在其他融合(即NTRK、RET)中证明了伴侣不可知诊断策略对于确定可能从治疗中获益的所有患者的重要性。例如,虽然ETV6-NTRK3是婴儿纤维肉瘤中最常见的NTRK3融合,但在研究拉罗替尼的临床试验中,20%的肿瘤被发现有非ETV6-NTRK3融合。
尽管具有显著的多样性,BRAF融合伴侣在一些组织学中富集。例如,90%有BRAF融合的毛细胞星形细胞瘤与KIAA1549发生重排,56%有BRAF融合的胰腺癌与SND1发生重排。组织学差异也见于ALK融合。在肺癌中,EML4-ALK融合占ALK融合变异体的84%,但在非肺癌肿瘤中占30%。研究应考虑BRAF融合的伴侣多样性及其在组织学和治疗应答中的作用。大量的融合伴侣突出了一个额外的诊断挑战,这可能限制了对激活融合的识别。由于BRAF融合的复杂性较高,因此专家指南在设计融合伴侣未知检测方法和解释结果时至关重要。
本研究使用了多种分子诊断方法来检测BRAF融合,包括基于组织的DNA/RNA NGS和基于血浆的ctDNA NGS。鉴于本研究的重点是探讨致癌性BRAF融合的临床情况,因此研究者没有质疑每种诊断方法的技术性能。然而,基于之前对其他激酶融合的研究,研究者有理由推断基于组织的RNA测序可能是检测BRAF融合的最敏感和最特异的方法。由于在基因水平上的BRAF重排通常发生在内含子内,因此基于DNA的NGS很难捕捉到这些事件(即灵敏度有限),除非内含子被充分覆盖。此外,基于DNA的NGS有可能检测非典型BRAF重排,这些重排可能会或可能不会导致致癌BRAF融合(即特异性有限)。在这两种情况下,基于RNA的二代测序可以通过直接在mRNA水平捕获致癌融合转录本而绕过基于DNA的NGS相关的技术问题,从而提供更敏感和更特异的分析。虽然基于ctDNA的方法可能允许对BRAF融合进行非侵入性检测,但基于DNA的NGS的局限性也与基于ctDNA的NGS检测相关,因为DNA是共同使用的。此外,基于ctDNA的NGS的性能可能会受到液体活检固有的其他问题的进一步限制,例如循环肿瘤DNA载量水平不同导致的灵敏度欠佳。因此,在组织和液体中整合多种正交和互补的NGS检测可能对于优化临床中致癌性BRAF融合的检测具有重要意义。
关于BRAF融合阳性肿瘤对靶向MAPK通路治疗的临床疗效,目前数据有限。有报道表明,BRAF融合可能对第一代BRAF抑制剂不敏感,甚至可能导致MAPK通路的反常激活。对泛RAF抑制剂开展的试验未能证明其对II类和III类变异的患者有益(例如NCT02296112)。少数观察靶向MAPK通路治疗的试验纳入了BRAF融合患者(非V600E亚组的一部分)。国家曲美替尼平台试验NCI-MATCH纳入了32例有BRAF非V600突变或融合的患者;没有一例BRAF融合患者有反应。联合RAF和MEK抑制剂治疗非V600 BRAF变异的癌症也未获得成功。Rustgi等人用比美替尼联合康奈非尼治疗了8例BRAF融合患者。治疗中活检显示不完全的ERK通路抑制,没有BRAF融合患者的肿瘤消退。相比之下,儿科脑肿瘤联盟在难治性/复发性低级别胶质瘤患者中开展了一项司美替尼的II期试验。在有BRAF融合的18例患者中,7例(39%)达到了PR。虽然现有疗法可能对一些BRAF融合患者有用,但发现更有效的疗法仍然是当务之急。
本研究报告了接受靶向MAPK疗法治疗的24例原发BRAF融合患者的结局。研究者证明,虽然缓解情况多样,但所有毛细胞型星形细胞瘤患者接受至少6个月的治疗,6例携带原发BRAF融合的患者接受12个月的治疗:3例毛细胞星形细胞瘤患者接受MEK抑制剂治疗,1例脑室外神经细胞瘤患者接受达拉非尼和曲美替尼治疗,1例黑色素瘤患者接受康奈非尼和比美替尼治疗,1例Erdheim-Chester病患者接受考比替尼治疗。虽然一些患者达到了显著缓解,但这一回顾性队列中患者的缓解率低于接受靶向治疗的其他融合基因(即ALK、ROS1、RET)阳性癌症,后者的总缓解率为60-80%。此外,应答似乎与组织学相关,这与BRAF V600E癌症患者接受达拉非尼和曲美替尼治疗的情况相似。
最后,BRAF融合越来越多地被认为是靶向MAPK通路治疗(尤其是EGFR TKIs)获得性耐药的频发机制(2%-4%)。为了规避耐药,临床前模型提示,针对获得性变异加用第二种药物可能有效。证明EGFR + BRAF和/或MEK抑制疗效的数据仅限于少数病例报告和前瞻性研究的亚组分析,最佳策略仍有待确定。Luo等人报道了厄洛替尼和曲美替尼治疗EGFR突变型肺腺癌患者的试验结果,这些患者对之前的EGFR TKI获得性耐药。23例患者中有2例肿瘤缩小,2例均携带BRAF融合。生物标志物匹配的ORCHARD试验(NCT03944772)包括一个有BRAF变异、并且接受奥希替尼和司美替尼治疗的队列。本研究在靶向治疗后确定了15例获得性BRAF融合的患者(10例为EGFR突变型肺腺癌患者)。其中2例患者在耐药时接受了EGFR TKI和MEK抑制剂治疗。值得注意的是,治疗时间最长的患者也携带BRAF V600E突变。研究者还表明,在针对其他致癌驱动基因的治疗后,BRAF融合成为非肺癌组织学中耐药的获得性机制。越来越多的文献认识到BRAF融合是TKI获得性耐药的频发机制,并且强调了疾病进展后常规基因分型的重要性。
本研究受到以下限制:回顾性的单一机构设计,在癌症治疗期间的不同时间点分析的异质性人群,以及接受每种治疗线和治疗类型的患者数量。尽管有这些局限性,本研究仍然是已报道的最大的BRAF融合患者队列之一,提供了重要的基因组数据,并且是少数报告靶向治疗结局的研究之一。
总之,本研究描述了携带BRAF融合的肿瘤患者的临床结局以及病理学和基因组特征。常规NGS检测的增加应用预计将发现更多的BRAF融合患者。大量的BRAF融合伴侣与其他致癌性融合形成鲜明对比,这凸显出专家分子病理学指导在识别致癌性融合和对其功能进行表征方面的重要性。研究者发现BRAF融合不仅是肺癌患者对EGFR TKI获得性耐药的机制,也是肺癌以外的其他癌症类型靶向治疗后获得性耐药的机制。这一观察结果证实了肿瘤进展后对肿瘤样本进行测序的重要性,以发现精确的治疗靶点。研究者最近对奥希替尼治疗后发生获得性耐药的肿瘤患者的治疗经验表明,如果找到靶点并给予匹配的靶向治疗,患者结局将得到改善。本研究的数据记录了中枢神经系统肿瘤、Erdheim-Chester病和黑色素瘤的应答,因此对这些患者进行这些变异的评估至关重要。靶向BRAF融合的新方法(包括BRAF二聚体阻滞剂、ERK抑制剂和靶向蛋白水解嵌合体(PROTACs)正在临床试验中,预计这些方法可能很快为BRAF融合阳性癌症患者提供更好的治疗。
参考文献:
Chen MF, Yang SR, Tao JJ, et al. Tumor-agnostic genomic and clinical analysis of BRAF fusions identify actionable targets. Clin Cancer Res. Published online June 26, 2024. doi:10.1158/1078-0432.CCR-23-3981



