湖南大学冯欣欣课题组JACS封面文章:细胞内相分离——干扰细菌内部有序度的“抗耐药性”抗菌策略
时间:2024-08-25 06:05:38 热度:37.1℃ 作者:网络
细菌耐药性的出现给全球健康带来了重大挑战,因此,我们迫切需要一种新的抗菌机制或策略来抵抗常见的细菌耐药机制及阻止耐药性进化。传统抗生素通常通过靶向细胞内的单一必需酶来破坏下游生物过程、并抑制细菌细胞生长。然而,细菌可以轻易地通过基因突变而进化出对这种单靶标抗菌机制的耐药性。
为了开发具有抵抗细菌耐药性进化特性的“抗-耐药性”抗菌药物,湖南大学冯欣欣课题组开发一种针对细菌胞内有序度扰动的抗菌策略,利用拟肽分子胞内自组装的方式,全局性地干扰细菌胞内蛋白定位和功能,并且产生“从内而外”的细菌膜爆破。这一策略不但能够高效杀灭多种临床常见的细菌病原体,并且能够有效抑制细菌耐药性的产生。拟肽分子具有很高的生物安全性,在多种细菌感染动物模型上展现了良好的治疗效果。相关成果以“Ligand Receptor Interaction Induced Intracellular Phase Separation: A Global Disruption Strategy for Resistance Free Lethality of Pathogenic Bacteria”为题,发表在J. Am. Chem. Soc.杂志上并被选为封面文章(图1)。

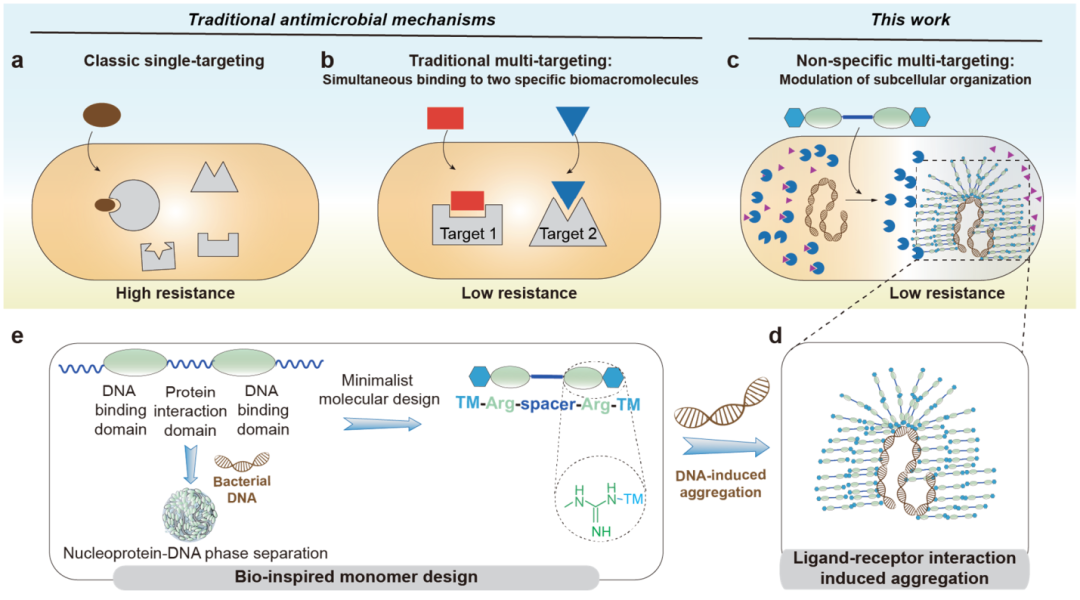
图1. 基于核蛋白与DNA的互作相分离启发的极简化拟肽分子设计、合成及受体配体相互作用实现胞内相分离或聚集体的形成,实现对细菌亚细胞器的扰动和由内而外的膜破裂抗菌新颖策略。
在本研究中,DNA诱导自聚集分子构建灵感来自于以DNA为中心的核蛋白相分离行为 (图1),采用极简化策略合成了一系列具有不同特性的末端修饰(TMs)和间隔连接子(Spacer)的二精氨酸拟肽(dAPMs),其结构如图2所示。
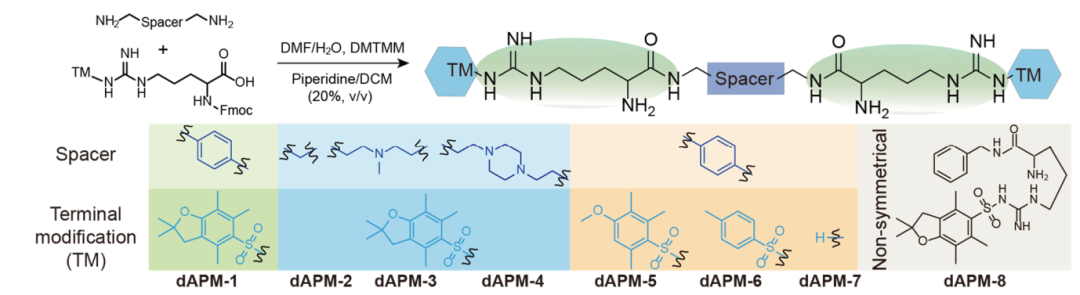
图2. dAPMs的合成及化学结构
体外DNA介导的dAPM自聚集
首先,作者验证分子设计的可行性,利用dAPMs (256 μg/mL)与OligoDNA (20 μg/mL)混合,结果表明dAPMs在DNA诱导自聚集强度各不相同,其中dAPM-1表现出最强烈的诱导聚集 (图3a)。进一步通过扫描电镜观察到聚集体是一种颗粒状形态,其主要成分通过EDS确定为dAPM-1,而非DNA-dAPM-1理论混合物。接着作者进一步通过流式和动态光散射(DLS)定量分析了最佳DNA诱导量为3-25 μg/mL,并确定了DNA诱导dAPM-1聚集的最低浓度为8 μg/mL(图3i)。
dAPMs显示出体外无耐药性抗菌活性和低真核毒性
在体外证实了DNA诱导dAPMs自聚集后,作者接着评估了其对ESKAPE病原体的抗菌活性,dAPM-1展现出最高的抗菌能力,特别是对革兰氏阳性细菌。对临床分离株和耐甲氧西林金黄色葡萄球菌(MRSA)的MIC低至4 μg/mL,与万古霉素相当(MIC = 4 μg/mL)。这一结果提示了dAPM-1通过一种不寻常的作用机制发挥作用的可能,dAPM-1的耐药性评价也表明具有优异的抗耐药特性,而传统抗生素在逐步耐药性进化过程中显示出60~130倍的MIC增加。同时溶血试验和细胞生长抑制实验表明dAPMs的细胞毒性很低,其HC50和IC50分别大于128和256 μg/mL(如图4所示)。

图3. 体外DNA诱导的dAPMs自聚集的表征。
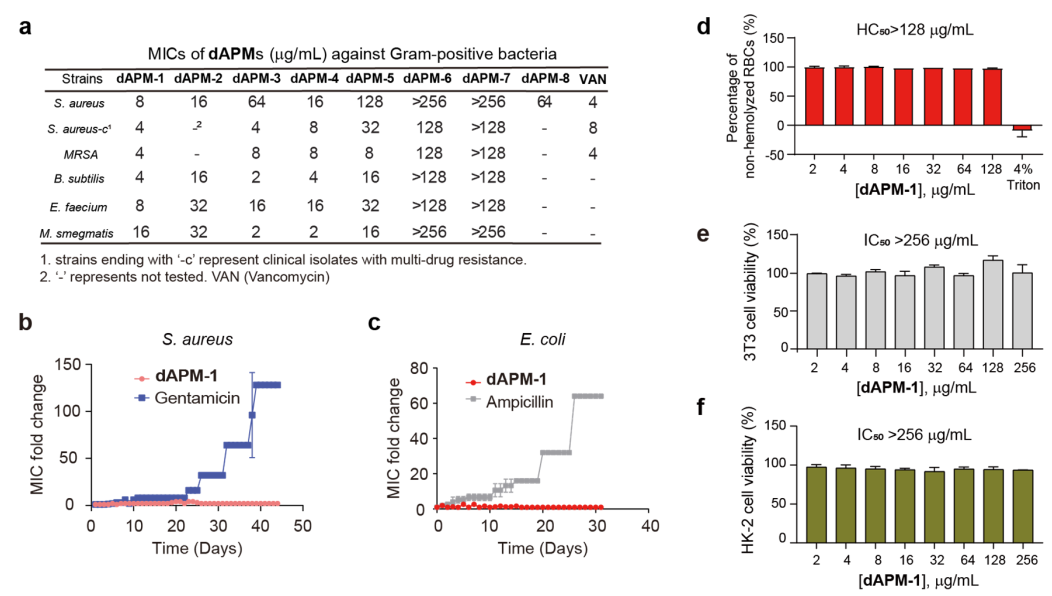
图4. dAPMs的抗菌活性和细胞毒性。
DNA诱导dAPM聚集的机制和结构基础
为了进一步探究DNA诱导dAPMs聚集的机制,作者提出dAPM-1与DNA通过多价结合成核触发,而随后的聚集则是由单体之间的非共价键驱动。dAPMs的自聚集倾向显示其自聚集与结构有关,dAPM-1展现出最高的自身浓度驱动倾向,所有其它dAPMs仅表现出中等或弱的自聚集活性,这表明间隔子和PBF在自聚集方面发挥了重要作用(如图5e)。核磁共振结果表明dAPM-1的自聚集行为依赖于所处溶剂;并进一步通过凝胶阻滞和ITC实验表明dAPMs双PBF基团对DNA亲和力至关重要(如图5h)。此外,另一个关键结构是精氨酸残基上的游离氨基,当用Boc保护时,在1H NMR中,DNA诱导的低场偏移、DNA结合能力、DNA介导的聚集行为以及抗菌活性完全消失。并且DNA诱导聚集体形成的程度与dAPMs的抗菌活性密切相关(图5k),提示细胞内聚集体形成可能是细菌细胞死亡的主要驱动力。
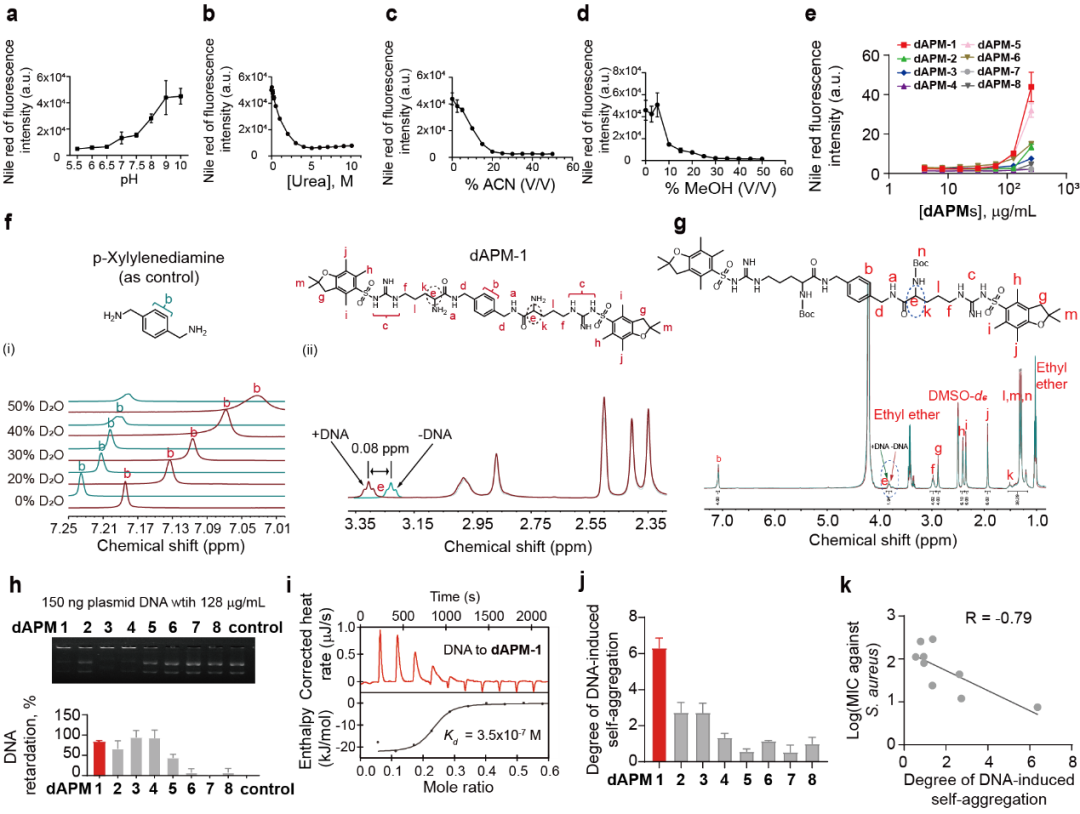
图5. DNA诱导dAPMs聚集构效关系分析。
细胞内DNA特异性诱导dAPM-1聚集
尽管作者验证了DNA诱导dAPM-1强烈的体外聚集,且表现出对细菌细胞优异的杀伤选择性和极低的细胞毒性,但这种选择性是否关联它们的聚集行为仍然未知。因此作者进一步选择革兰氏阳性菌枯草芽孢杆菌(Bacillus subtilis)作为模型菌株,研究了体内DNA介导的dAPM-1细胞内聚集行为,流式定量和confocal成像表明高度特异性的细胞内聚集体形成,仅在细菌细胞中观察到,而在哺乳动物细胞中并未观察到(如图6c)。作者进一步使用细菌膜主要磷脂成分(PG, PE)和哺乳动物细胞膜主要成分(PC,胆固醇)与dAPM-1的亲和力测试来解释这种差异积累的原因,ITC分析显示,dAPM-1对PE和PG具有较强的结合亲和力Kd值分别为9.5×10-7 M和7.8×10-5 M,而其与PC和胆固醇的结合最小(图6f)。如此显著的差异足以诱导细胞特异性摄取(如图6d)。
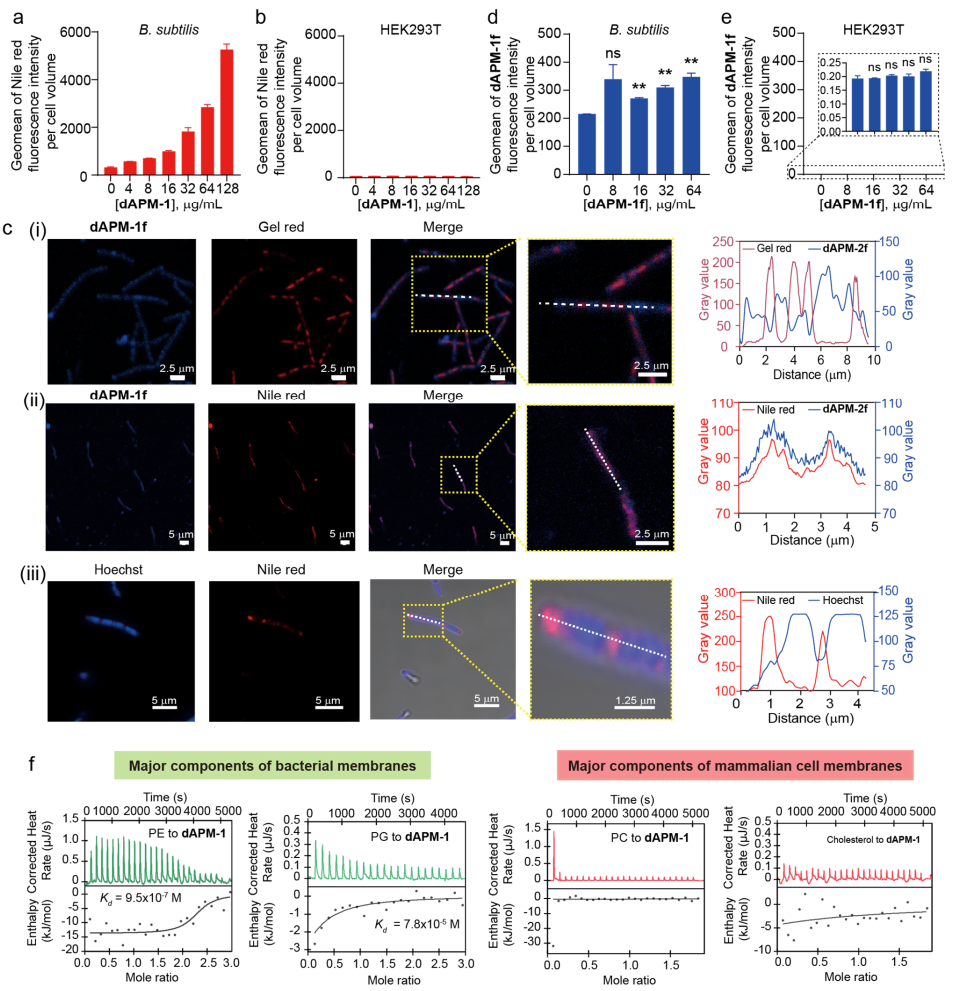
图6. 细菌特异性DNA诱导dAPM-1自聚集证据。
dAPM-1聚集体对多种蛋白质具有亲和力并导致细菌亚细胞组织紊乱
作者证实了dAPM-1在细胞内的聚集形成和抗菌效果后,那么这种聚集体如何干扰细胞内的亚细胞空间秩序,实现细菌细胞的全局破坏?首先利用dAPM-1聚集体的两亲性对聚集过程中本地蛋白(包括GFP、mCherry、β-半乳糖苷酶(β-Gal)、蛋氨酸氨基肽酶(MAP)、α-溶血素和辣根过氧化物酶(HRP))共沉淀的可能性进行确认,共聚焦显微镜和流式细胞术检测结果表明dAPM-1聚集体可以与各种不同蛋白质形成更大的聚集体。这提示聚集体可能干扰细菌内蛋白质组成的正常亚细胞空间组织。因此作者建立了控制细菌分裂过程中精确分离染色体和质粒的ParABS系统作为一个代表性例子来说明由dAPM-1聚集体引起的蛋白质组组织紊乱的生物学后果,体外重构了ParB的parS依赖性CTPase活性,并观察到dAPM-1存在时对催化活性的剂量依赖性破坏抑制(如图7cd)。最后,在dAPM-1聚集体存在的情况下,亚细胞组织的紊乱也对DNA的转录和翻译过程产生了显著的抑制作用(如图7ef)。
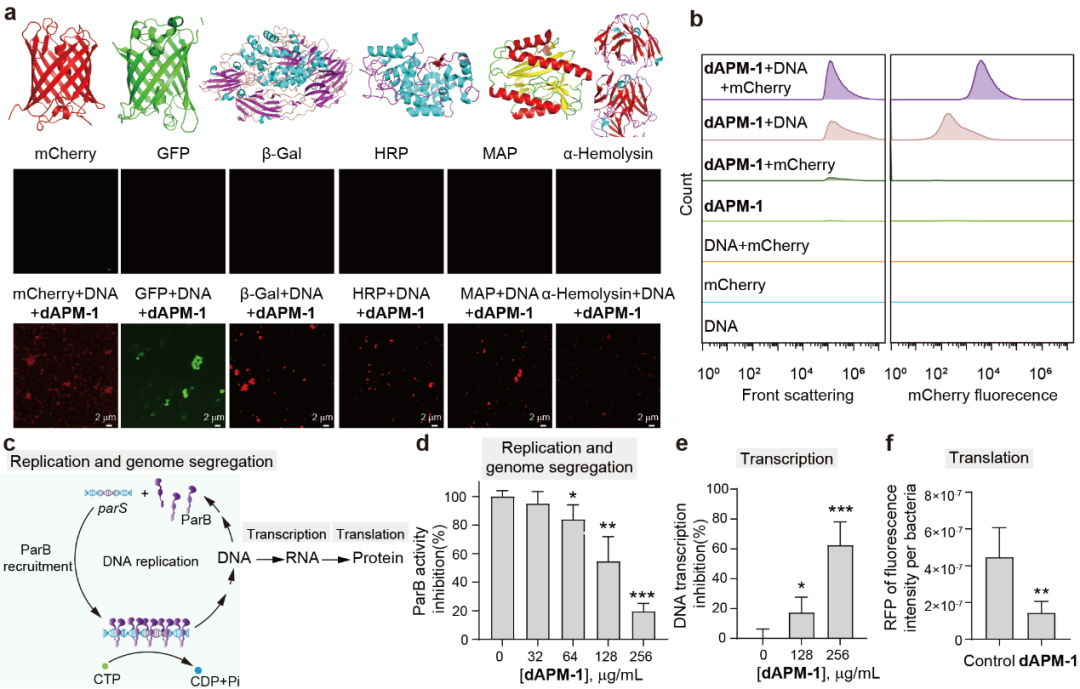
图7. dAPM-1聚集体与多种蛋白质的相互作用及其生物学后果影响的证实。
dAPM-1在细菌中的自聚集与膜破裂
dAPM-1聚集体参与破坏正常亚细胞空间组织的全局破坏机制外,其还显示破坏细菌膜活性。TEM成像观察到dAPM-1处理金黄色葡萄球菌后内膜曲率具有“平滑”现象并消除了内膜曲率,这种相互作用可能最终导致内源性膜暴露和细胞质内容物泄漏。为进一步证实细胞膜损伤是由细胞内生长聚集的dAPM-1聚集体引起,而非来自细菌细胞外部的单个dAPM-1单体单元的直接作用,作者使用具有内膜(IM)和外膜(OM)的革兰氏阴性大肠杆菌进行实验验证,dAPM-1处理周质表达mCherry的大肠杆菌时,共聚焦成像显示mCherry从周质扩散到细胞质,充满整个细菌细胞,随着dAPM-1聚集体的继续生长,观察到OM破裂,mCherry最终从细胞中泄漏出来,导致细胞群荧光急剧下降甚至消失(如图8cd)。此外,从转录组学层面也证实dAPM-1对与定位、细胞组分组织/生物发生和转运蛋白活性相关的基因产生了重大影响。
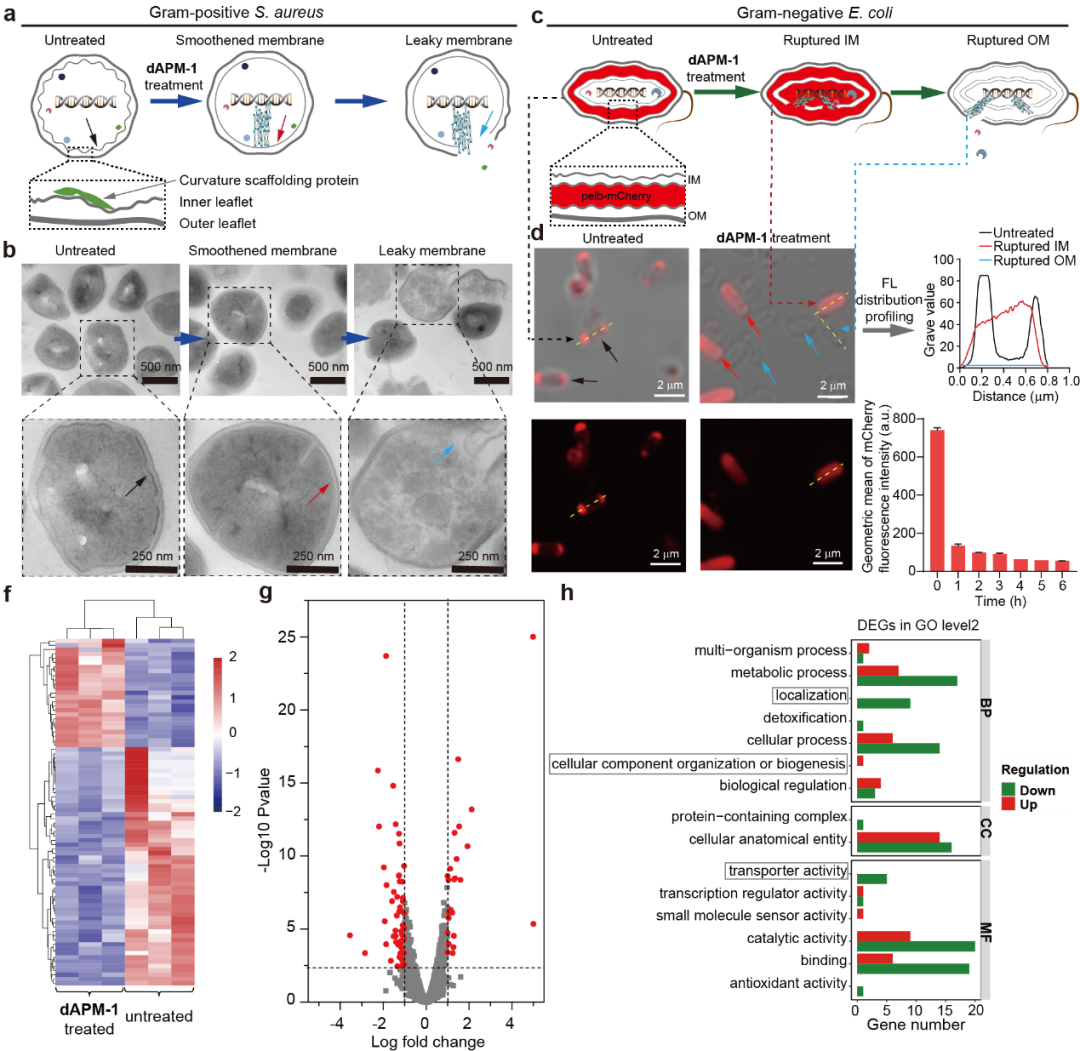
图8. dAPM-1对金黄色葡萄球菌的破膜作用及转录组学全局分析。
dAPM-1在多种小鼠模型中显示出体内功效
最后,作者比较了dAPM-1与经典DNA结合和膜渗透抗菌剂的相关生物活性,证实了dAPM-1并不是传统的DNA结合抑制与膜扰动对细菌进行破坏,其表现出的低活体毒性具有较大的活体治疗潜力。因此作者建立了三种不同的细菌感染的小鼠模型(表皮伤口感染、皮下囊肿和败血症),在dAPM-1处理组均优异地降低细菌的载量或拯救延长小鼠的寿命。
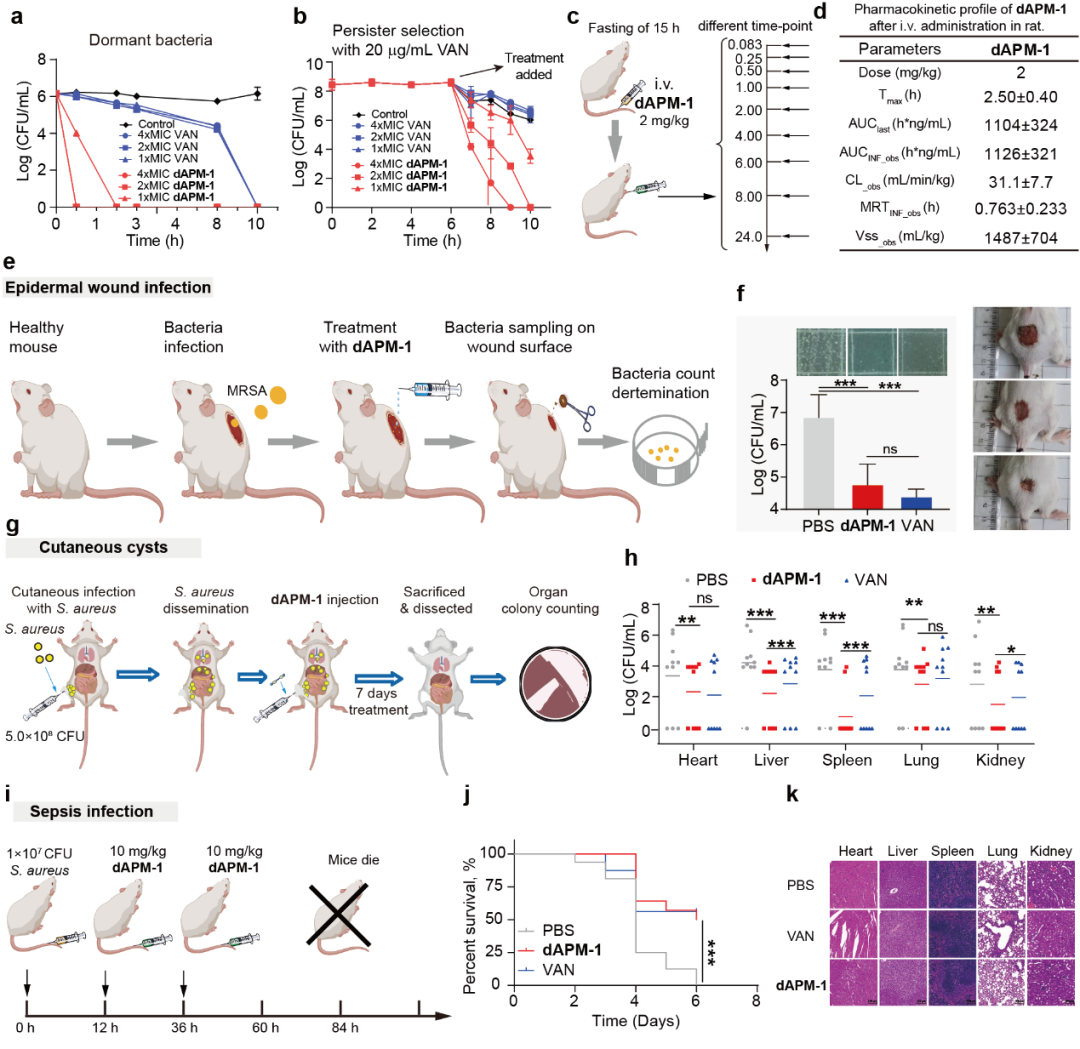
图8. dAPM-1的体外抗菌特性和体内功效评价。
总的来说,研究团队开发了一种通过配体-受体相互作用诱导的细胞内相分离的全局性破坏的多靶向抗菌策略,涉及细菌亚细胞组织的调节,有效地抑制了耐药性的发展。dAPM-1的特异性摄取及其在细胞内的聚集可导致亚细胞组织的紊乱,干扰细菌的基本功能并导致膜破裂。dAPM-1这种独特的作用模式有助于其广泛的抗菌谱,它有效地针对临床显著的多重耐药细菌以及生活方式多样化的细菌,这使它成为推进开发抗耐药抗菌策略提供了有效案例与全新的思路。这项研究成果已发表在Journal of the American Chemical Society上,第一作者是湖南大学化学化工学院已毕业博士生杨安明,通讯作者为湖南大学化学化工学院的冯欣欣教授。
参考文献
Ligand–Receptor Interaction-Induced Intracellular Phase Separation: A Global Disruption Strategy for Resistance-Free Lethality of Pathogenic Bacteria
Anming Yang, Junfeng Song, Jiaqi Li, Youzhi Li, Silei Bai, Cailing Zhou, Min Wang, Yu Zhou, Kang Wen, Miaomiao Luo, Peiren Chen, Bo Liu, Huan Yang, Yugang Bai, Wing-Leung Wong, Qingyun Cai, Huangsheng Pu, Yu Qian, Wenhao Hu, Wei Huang, Muyang Wan, Chunhui Zhang, and Xinxin Feng*
J. Am. Chem. Soc. 2024, DOI: 10.1021/jacs.4c04749
冯欣欣课题组简介
冯欣欣,湖南大学化学化工学院教授。2009年于南京大学取得学士学位(导师:宋友老师),2009-2017年在美国伊利诺伊大学(香槟校区)攻读博士学位及进行博士后工作,2017年9月起就职于湖南大学。冯欣欣课题组的主要科研方向为基于细菌细胞膜及DNA的多靶向“抗-耐药性”抗菌药物的开发及其化学生物学研究,在相关领域发表SCI论文50余篇,包括Sci. Adv.、JACS、PNAS等。
原文链接:
https://pubs.acs.org/doi/epdf/10.1021/jacs.4c04749


