JEV:脂肪组织来源的干细胞细胞外囊泡通过骨保护素和miR-21-5p缓解骨质疏松症
时间:2021-10-25 12:01:56 热度:37.1℃ 作者:网络

骨质疏松症是一种最常见的骨骼疾病,其主要原因是骨形成和骨吸收失衡,导致骨组织定量丢失。干细胞来源的细胞外小泡(EVS)作为一种新型的无细胞治疗药物,由于其优于亲代干细胞而受到越来越多的关注,因此,探讨脂肪组织来源的EVS在骨质疏松发病机制中的作用。
方法:采用基于切向流过滤(TFF)系统的多重过滤系统分离ASC-EV,并用透射电镜、动态光散射、Zeta电位、流式细胞仪、细胞因子阵列和酶联免疫吸附试验对其进行表征。
结果:EVS富含与骨代谢和间充质干细胞(MSC)迁移相关的生长因子和细胞因子。尤其是核因子受体激活剂κB配体的天然抑制剂--护骨素在ASCEV中高度富集。我们发现静脉注射ASC-EVS可以减轻骨质疏松小鼠的骨丢失。ASC-EVS明显抑制巨噬细胞的破骨细胞分化,促进骨髓间充质干细胞(BM-MSCs)的迁移。然而,OPG缺失的ASC-EVS没有显示出抗破骨细胞生成的作用,这表明OPG对ASC-EVS的治疗效果至关重要。此外,我们还对小分子RNA测序数据进行了分析,以确定与抗骨质疏松相关的miRNA候选基因。Asc-EVS中的miR-21-5p通过下调Acvr2a来抑制破骨细胞的分化。此外,let-7b-5p在 ASC-EVs显著降低了破骨细胞形成相关基因的表达。ASC-EVS经静脉注射后到达骨组织,且持续时间较长。
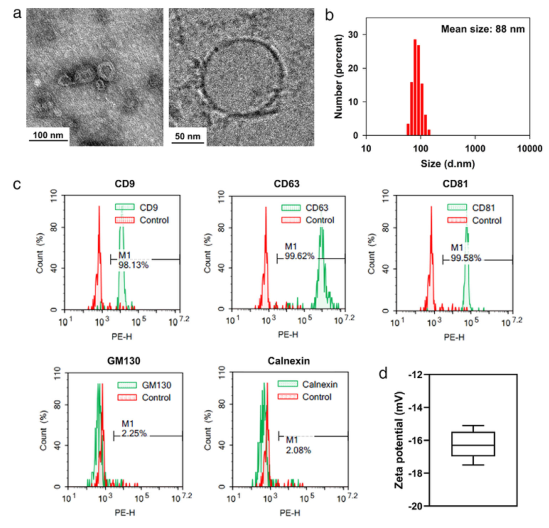
图1 从人ASCs分离的EVS(ASC-EVS)的特性。(A)ASC-EVS的经典和低温透射电子显微镜(TEM)图像。比例尺,100 nm(左)和50 nm(右)。(B)用动态光散射法测定ASC-EVS的粒径分布。(C)EV表面标志物(CD9、CD63和CD81)和内部蛋白标志物(GM130和Calnexin)的流式细胞术分析。(D)测量ASC-EVS的Zeta电位。ASC-EV的平均Zeta电位为-16.3 mV
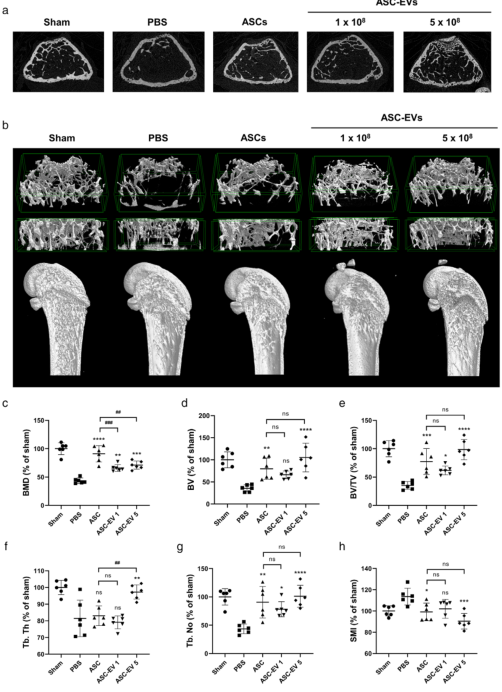
图2 给予ASC-EVS可改善去卵巢小鼠的骨质疏松症表型。(A)具有代表性的骨小梁横断面图像;(B)股骨三维重建图像。(c-h)股骨骨小梁微结构的定量分析。首次治疗4周后,取左侧股骨,用μCT测量骨小梁结构指数。数据均数±标准差(n=6)。**p<0.001;*p<0.0001;##p<0.01;#p<0.001。BV,骨体积;BV/TV,骨体积百分比;TB。TH,骨小梁厚度;TB。否,骨小梁数量;SMI,结构模型指数
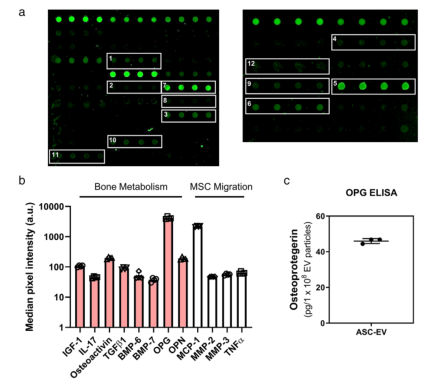
图3 EV细胞因子与骨代谢的关系。(A)细胞因子阵列的代表性荧光图像。(1)胰岛素样生长因子-1、(2)白细胞介素-17、(3)骨激活素、(4)骨形态发生蛋白-6、(5)骨形态发生蛋白、(6)骨桥蛋白、(7)单核细胞趋化蛋白-1、(8)基质金属蛋白酶-2、(9)基质金属蛋白酶-3、(10)转化生长因子-β1、(11)肿瘤坏死因子-α和(12)骨形态发生蛋白-7。(B)细胞因子的中位数像素强度。(C)酶联免疫吸附试验(ELISA)测定OPG蛋白表达。数据为平均值±SD
结论:ASC-EVS中的OPG、miR-21-5p和let-7b-5p可抑制破骨细胞分化,减少骨吸收相关基因的表达,提示ASC-EVS有望成为治疗骨质疏松的无细胞治疗剂。
原文出处:
Lee KS, Lee J, Kim HK,et al.Extracellular vesicles from adipose tissue-derived stem cells alleviate osteoporosis through osteoprotegerin and miR-21-5p.J Extracell Vesicles 2021 Oct;10(12)


