四川农业大学王显祥教授《ACS AMI》:氧化锰纳米酶温敏凝胶治疗肠炎
时间:2023-07-18 23:12:50 热度:37.1℃ 作者:网络
炎症性肠炎(IBD)与纳米酶
炎症性肠病(IBD),如克罗恩病(CD)和溃疡性结肠炎(UC),对世界各地的患者构成严重威胁,炎症从本质上来说是机体的一种防御性反应,这种防御反应主要是活体组织对损伤因子而产生的。在慢性炎症时,在创口会有大量肥大细胞以及白细胞聚集,摄取大量氧分子,进而导致创口部位产生并蓄积大量活性氧(reactive oxygen species,ROS),长时间的蓄积可能会导致宿主出现许多慢性病。因此,清除过量的ROS对抑制肠炎的发生或发展至关重要。在ROS清除方法中,活性高,制备简单且稳定性好的纳米酶是一种有效的解决方法。
然而,在肠道,由于肠道蠕动,肠内容物多且成分复杂,用于清除ROS的纳米酶以溶液形式在病变部位容易被肠道在短时间内清除并排泄出体外,局部药物浓度无法在一定时间内维持在较高水平等等。
温敏凝胶搭载四氧化三锰纳米酶干预治疗IBD
四氧化三锰纳米酶(Mn3O4 Nps)是一种典型的纳米酶,在许多抗炎的研究中均有较好效果,同时,在现有的法规标准中,一些功能性食品和药品均可添加锰元素,这也证明了锰作为微量营养元素较为安全。温敏性水凝胶作为一种经典的载药新材料,可以让纳米酶进入到病变肠道组织,缓慢释放药物,达到对病变位置治疗的目的。
近期,四川农业大学王显祥教授等人合成了温敏水凝胶搭载四氧化三锰纳米酶用于对DSS诱导小鼠结肠炎进行干预治疗,并评估了材料的体内外安全性和材料介导的纳米治疗小鼠结肠炎机制,相关工作以“Mn3O4 Nanozyme Loaded Thermosensitive PDLLA-PEG-PDLLA Hydrogels for the Treatment of Inflammatory Bowel Disease”为题发表在“ACS Appl. Mater. Interfaces”。

【文章要点】
在这项研究中,作者构建了一种以PDLLA-PEG- PDLLA嵌段共聚物复合水凝胶作为载体,搭载具有多酶活性的四氧化三锰纳米颗粒。对其分别进行了体外表征及体内外安全性评估,结果显示所制备材料MLPPP具有较好的生物安全性,复合材料特有的温敏特性是结直肠部位给药系统的理想特征,材料温敏特性如图1所示:
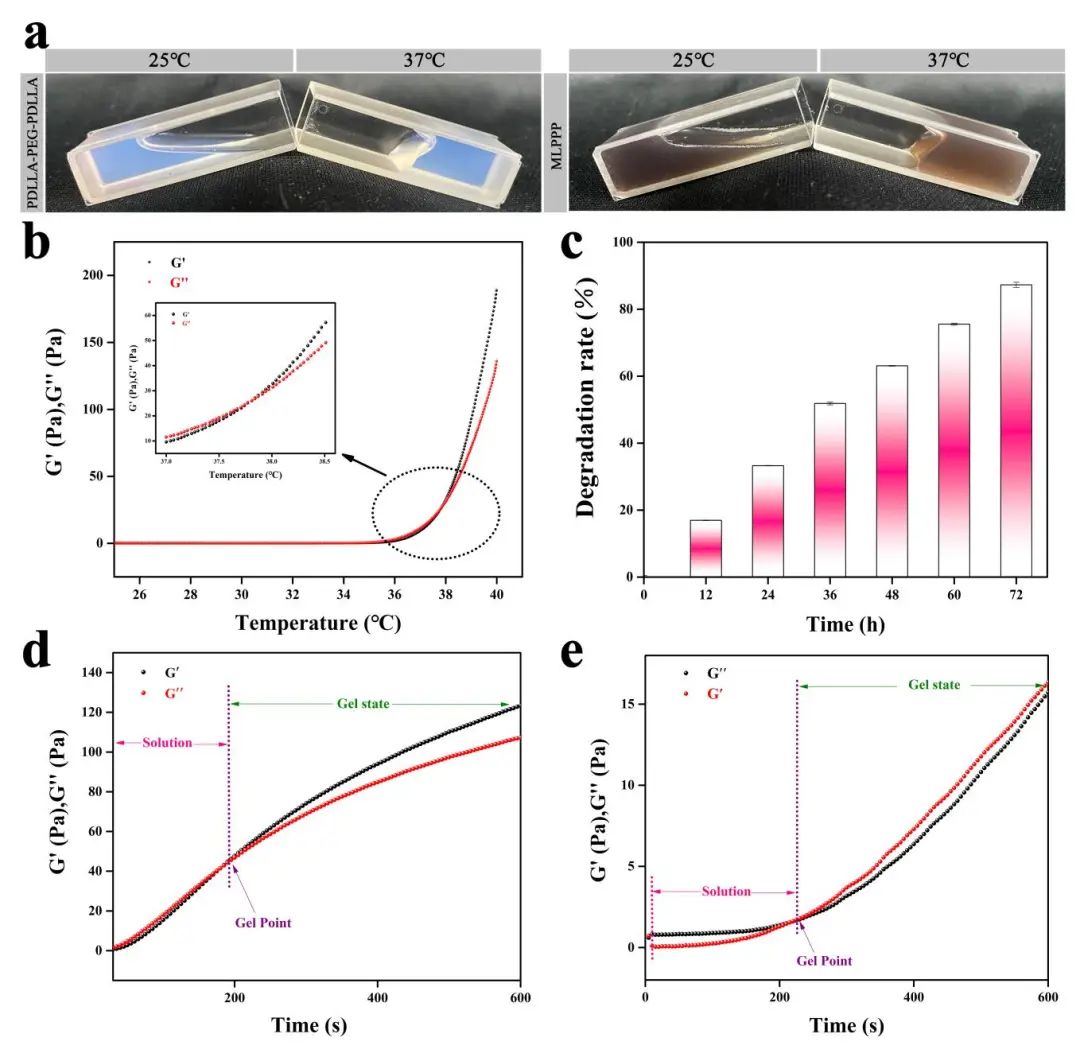
图1:MLPPP温敏室温和体温状态下的形态对比
作者首先通过DSS溶液使小鼠自由饮水制备结肠炎模型,并探究不同给药剂量条件下MLPPP对小鼠结肠炎的治疗作用,观察发现,与阳性组比较而言,MLPPP干预治疗的小鼠组表现出明显改善的结肠炎症状,体重减轻趋势较小,DAI评分较低,结肠缩短较少。生化指标中生物标志物-髓过氧化物酶(MPO)活性显著降低,从侧面证明治疗组对结肠中性粒细胞浸润进行了抑制。除此以外,对不同组别分别进行结肠炎治疗组织病理学研究,结果均表明MLPPP可以有效缓解DSS诱导的结肠炎症状(图2)。
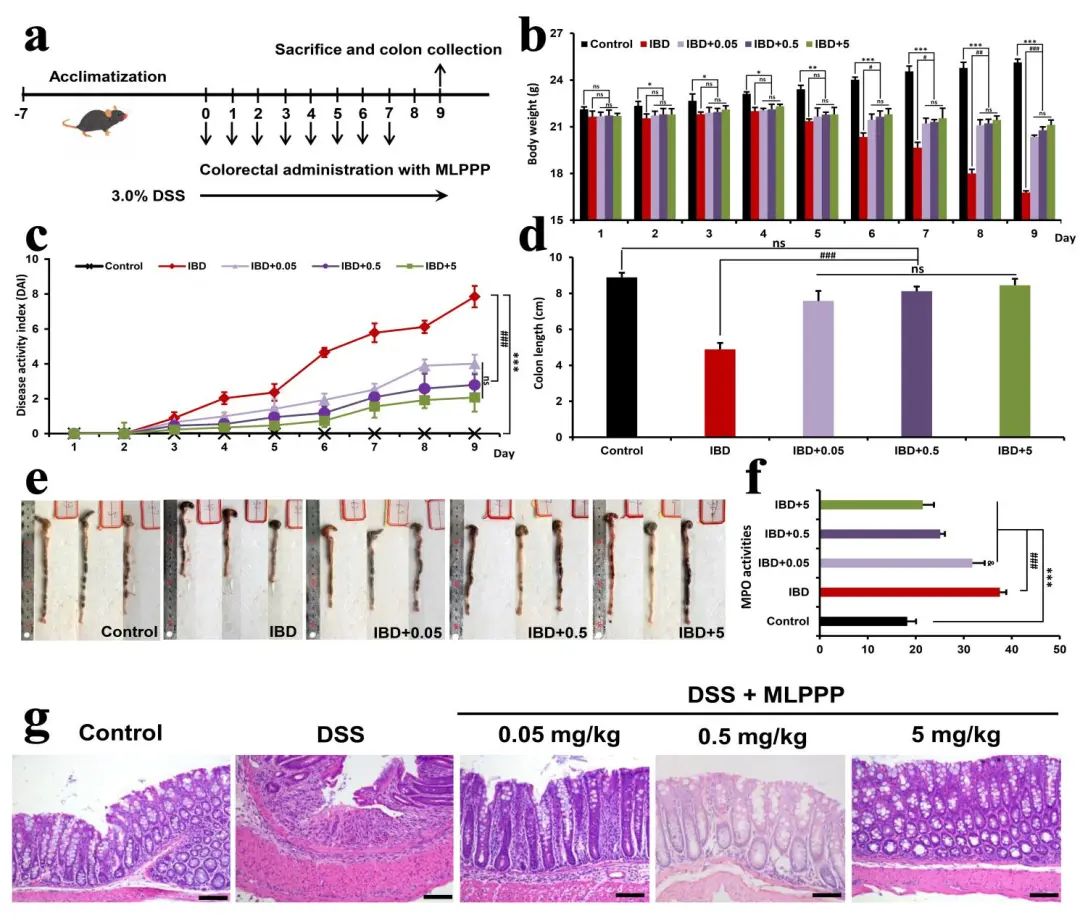
图2 MLPPP抑制结肠炎临床指标
为了验证MLPPP对结肠氧化应激的作用,作者检测了阳性对照组和治疗组的氧化损伤标志物丙二醛(MDA)表明治疗组中,结肠组织中MDA显著降低。并经过MLPPP处理后,包括T-AOC、CAT、GPx和SOD活性以及GSH水平在内的抗氧化能力也得以恢复。
此外,结果还证实,MLPPP可以清除RAW 264.7巨噬细胞中LPS诱导的ROS水平。通过检测抗氧化途径Nrf2-keap1信号通路。发现阳性组keap1蛋白水平的增加和Nrf2蛋白水平的降低,这表明Nrf2-keap1信号通路在阳性组的结肠炎小鼠中被抑制,经过MLPPP处理后则对这种抑制作用进行了逆转。同时,检测了Nrf2-keap1信号通路的下游蛋白,结果表明,采用复合材料MLPPP处理后,NADPH醌氧化还原酶1(NQO1)和血红素加氧酶1(HO-1)水平升高。与此同时,相比于阳性组,MLPPP干预组的抗氧化酶(CuZn-SOD、Mn-SOD和CAT)的mRNA水平显著性增加。总之,MLPPP的抗氧化活性可能通过直接清除活性氧并对Nrf2介导的细胞抗氧化路径来发挥作用(图3)。
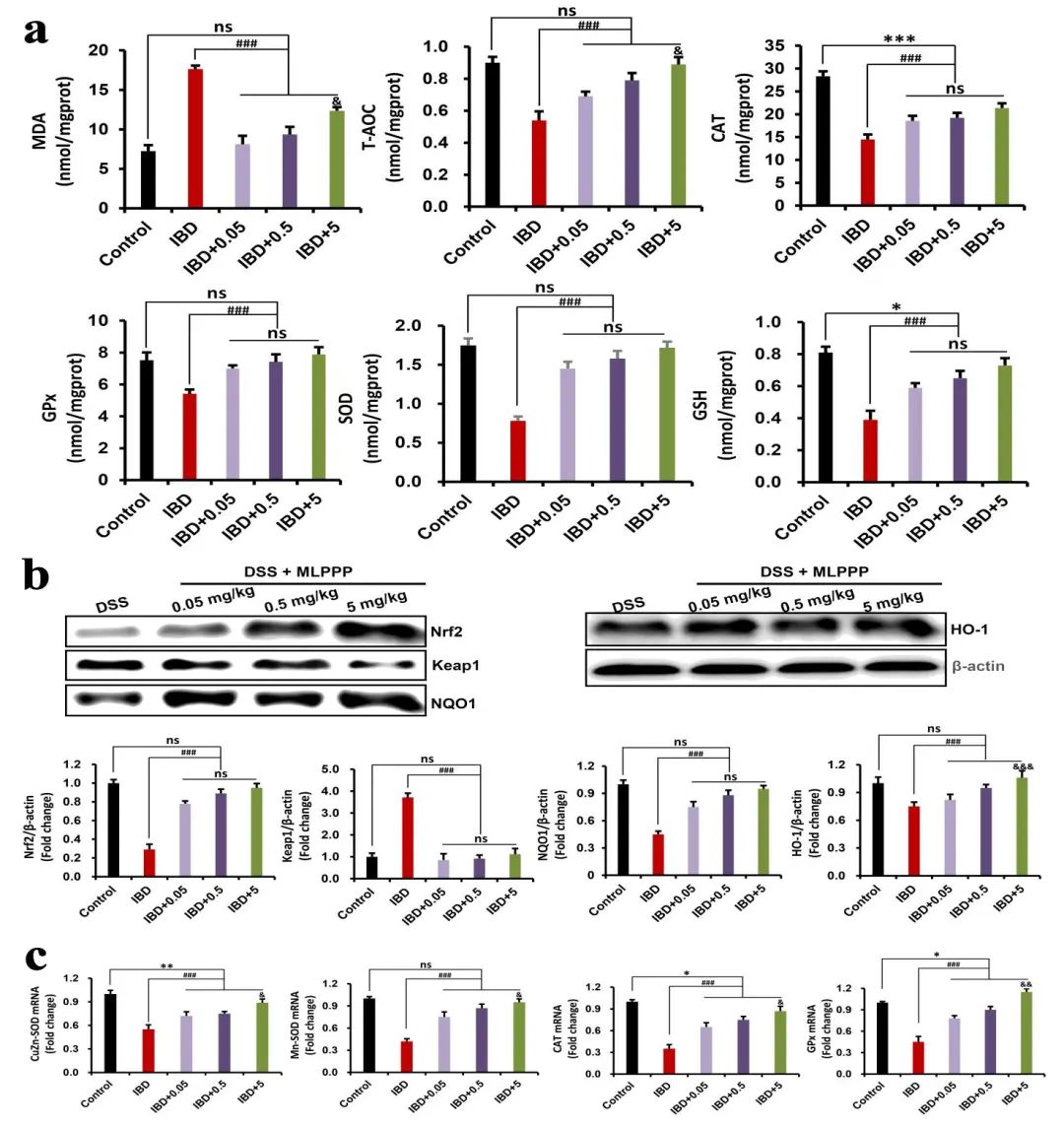
图3:MLPPP抑制DSS在小鼠结肠中诱导的氧化损伤
作者还研究了MLPPP对DSS诱导的结肠炎症反应的影响。结果表明,阳性组中血清和结肠中的促炎细胞因子IL-1β、IL-6、TNF-α和IFN-β水平显著升高,而在治疗组中,上述促炎细胞素含量的增长发生了抑制。采用West Bloting实验对各组促炎细胞因子进行mRNA表达分析,MLPPP治疗组别小鼠通过DSS明显消融增强的IL-1β、IL-6、TNF-α和IFN-βmRNA表达。此外,Toll样受体4(TLR4)/核因子κB(NF-κB)途径的参与的结肠炎反应密切相关,TLR4和p–NF-κB蛋白水平的增加和IκBα蛋白水平的降低表明在结肠炎小鼠中TLR4/NF-µB途径被激活。相反,采用MLPPP可以逆转DSS导致的肠炎引起的结果。使用RAW264.7细胞在体外研究MLPPP的抗炎活性,在用MLPPP预处理然后用LPS进一步刺激细胞后,发现MLPPP以剂量依赖性方式抑制LPS诱导的炎症。通过与LPS组的比较,治疗组的促炎细胞因子(IL-1β、IL-6、TNF-α和IFN-β)的蛋白水平和mRNA表达显著降低。此外,实验结果显示,MLPPP还对LPS诱导的炎症具有抗炎作用,因为MLPPP可以抑制LPS诱导TLR4/NF-κB通路的激活,在RAW264.7细胞中,LPS触发的NF-κB的核移位也被PMNFs抑制。综上所述,PMNFs的抗炎活性主要表现为抑制TLR4/NF-κB的激活(图4,5)。
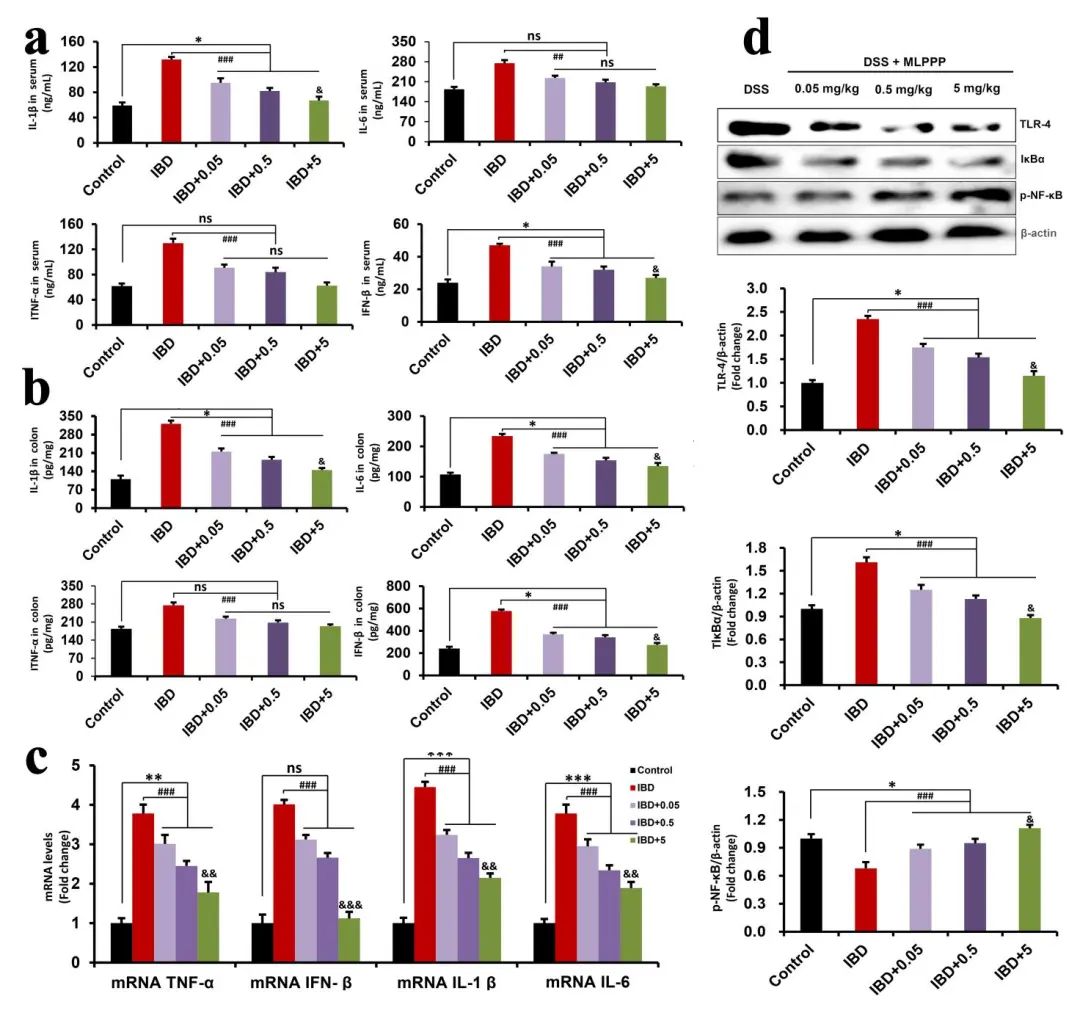
图4:MLPPP抑制DSS在小鼠结肠中诱导的炎症
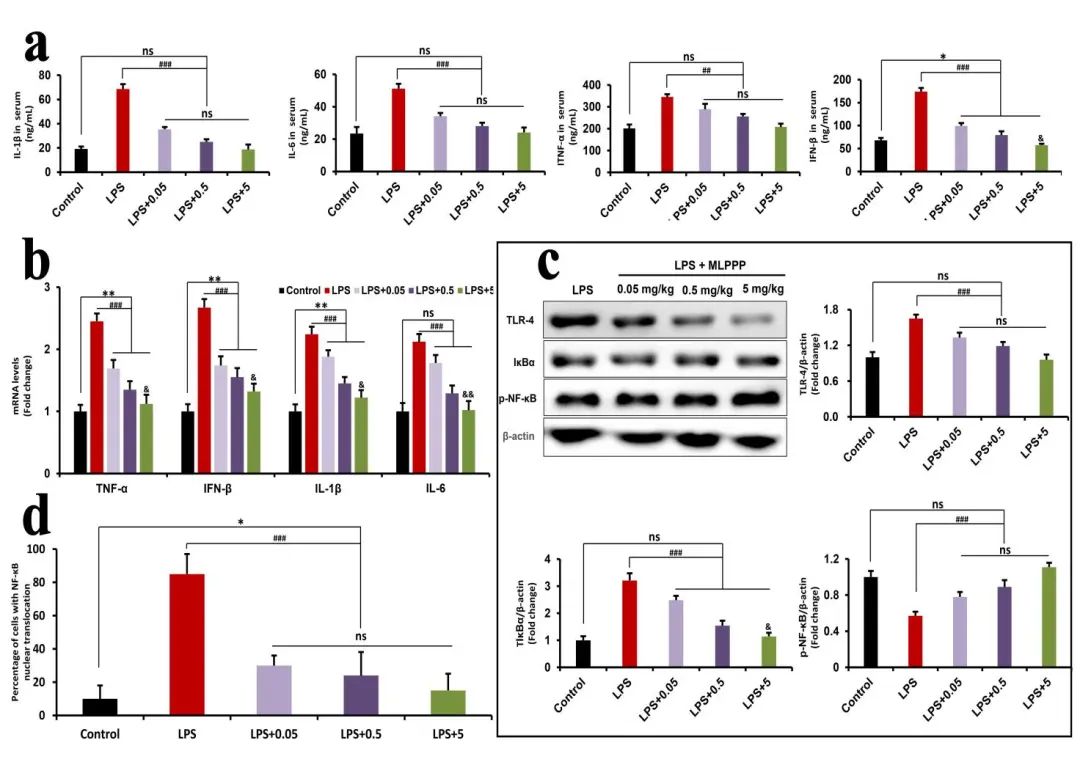
图5:MLPPP抑制LPS致细胞炎症
最后,作者检测了结肠中粘蛋白-2(MUC-2)含量水平。MUC-2是杯状细胞分泌的最丰富的粘液蛋白,结果显示,与DSS组的结果相比,MLPPP治疗导致MUC-2表达增加, DSS处理组中的小鼠表现出杯状细胞的减少,而MLPPP处理显著增加了杯状细胞。这表明MLPPP可以维持结肠粘膜层的完整性并保护杯状细胞。阳性组小鼠的紧密连接(TJ)蛋白(claudin-1、闭塞素和ZO-1)显著减少,但MLPPP处理组显示对这三种TJ蛋白进行了修复,进而恢复了肠粘膜屏障的完整性。综合这些结果,可以得出结论,MLPPP对DSS诱导的结肠炎的抑制也与其对上皮和粘膜屏障的保护有关(图6)。
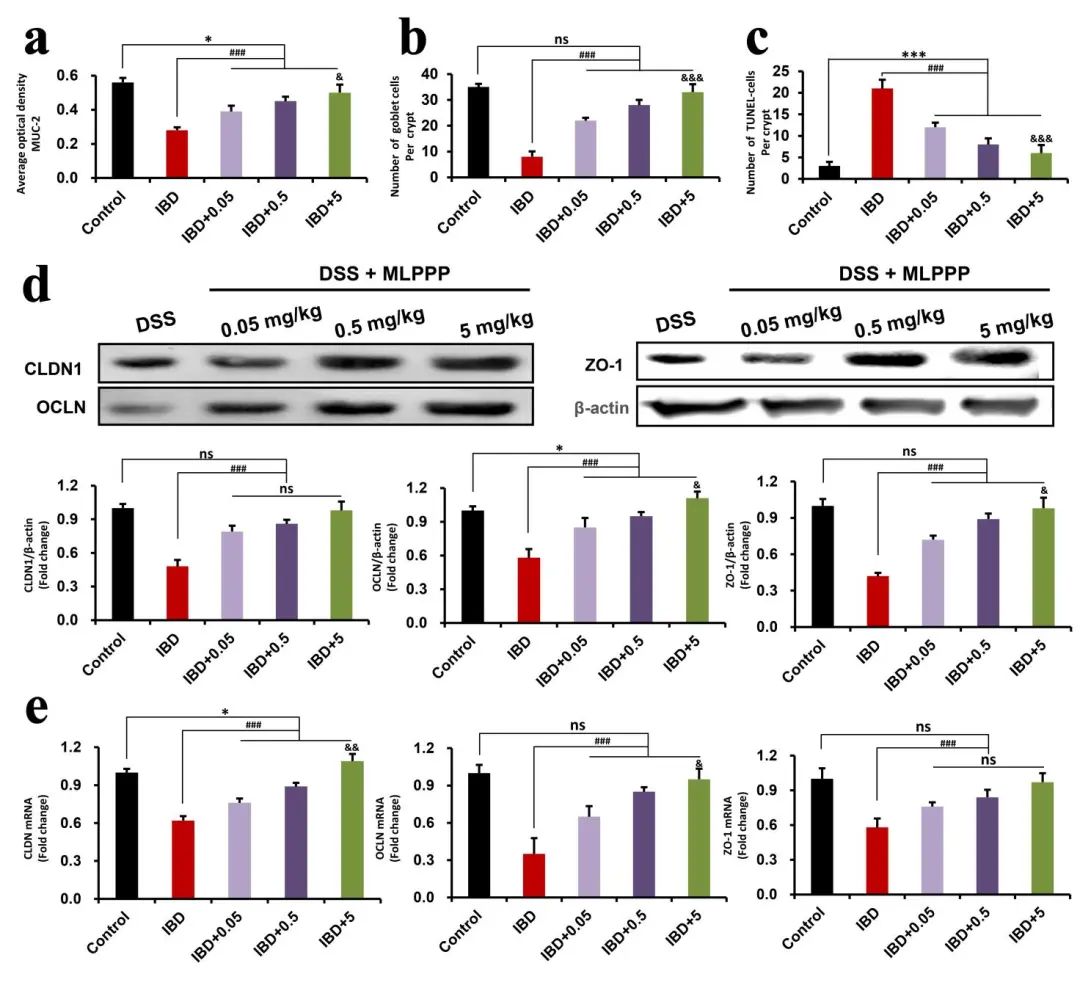
图6:MLPPP改善肠炎小鼠肠道屏障破坏
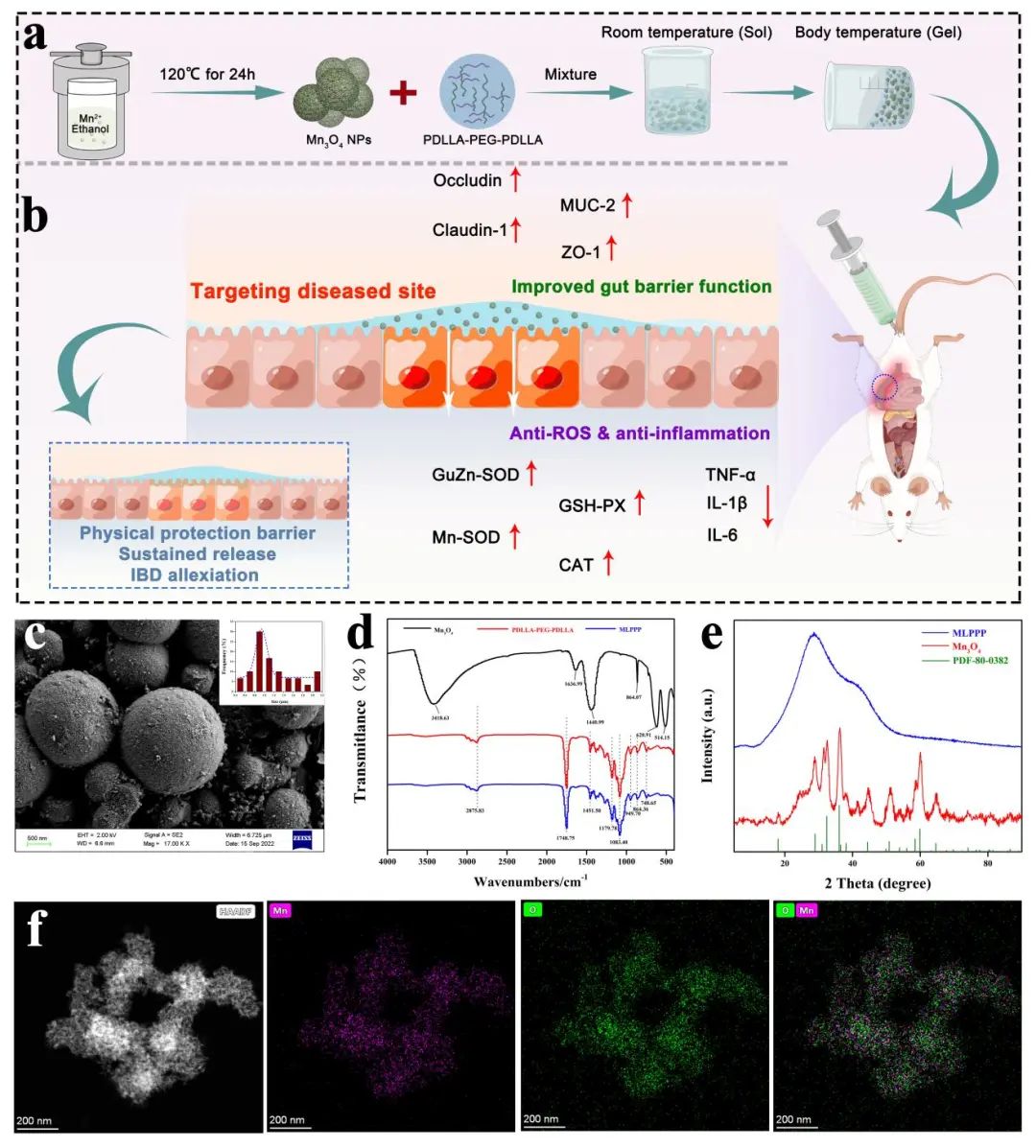
图7:MLPPP改善肠炎小鼠机理图
【结论与展望】
MLPPP作为一种温敏水凝胶复合纳米材料,其具有多酶活性(如CAT、GPx和SOD)和抗氧化作用。MLPPP的这种纳米材料特性使得自己能够直接靶向到达肠炎病变部位,并通过直接清除ROS,重建Nrf2介导的细胞抗氧化系统以及通过抑制TLR4 / NF-B途径以及上调TJ蛋白和改善上皮细胞凋亡来维持肠道屏障来缓解DSS诱导的结肠炎症状。综上来说,结果证明了MLPPP在抑制结肠炎方面的独特作用,以及用于治疗各种氧化应激相关疾病的潜在希望。
原文链接:
https://pubs.acs.org/doi/10.1021/acsami.3c03332


