Eur J Radiol:T1 mapping在腮腺良恶性肿瘤鉴别中的价值
时间:2023-08-01 15:28:29 热度:37.1℃ 作者:网络
腮腺肿瘤占唾液腺肿瘤的70%,涉及的病理类型十分广泛,其中大多数是良性肿瘤(BTs)。多形性腺瘤(PA)是最常见的病理类型,其次是Warthin氏瘤(WT)。治疗策略和预后因肿瘤的组织学类型不同而有很大差异。PA的复发率为6.7%-45%,前五年的恶性率为1.5%,并逐渐增加。因此,临床上建议进行根治性手术。然而,WT很少复发,恶性转化占WT的0.1%-0.3%。因此,腮腺部分切除术、切除术或保守治疗是治疗WT的常用方法。然而,腮腺恶性肿瘤(MT)需要进行全腮腺切除术。因此,对BT和MT以及各种亚群肿瘤的准确鉴别诊断对于正确的治疗方法至关重要。
传统的磁共振成像(MRI)可以提供头颈部肿瘤的定位、形态、内部结构、扩散、侵袭和周围神经扩散等信息。然而,MRI是定性检查,缺乏一个客观的评估系统。现阶段,量化MRI已经成为评估肿瘤特征的研究热点。扩散加权成像(DWI)对水分子的运动敏感,由DWI计算出的表观扩散系数(ADC)值可用于定量评估组织中的扩散程度,已被广泛用于头颈部肿瘤的诊断和鉴别 。尽管少数腮腺肿瘤的ADC值因其成分的性质而有重叠,但当DWI与常规MRI结果一起使用时诊断的准确性可以提高。传统的回声平面成像DWI(EPI-DWI)经常受到几何失真和T2*模糊的影响。与传统DWI相比,长可变回波束DWI(RESOLVE-DWI)的读出分割具有更好的信噪比、更少的变形和伪影、质量更高。纵向弛豫时间(T1)是一个基于组织内在生物物理特性的物理参数,一个单一的T1值有可能成为体内的生物标志物。传统的T1加权成像(T1WI)是定性的,其信号强度取决于使用MRI硬件和软件操作的许多互补性对比机制。另外,其与造影剂浓度没有线性关系。T1 mapping可以克服T1WI的缺点,可以评估每个图像体素的T1,从而提供一个独特的、稳定的、可量化的、可重复的内在组织值。总的来说,每种组织类型的T1值都在正常范围内;任何偏离这些值的情况都表明有疾病或生理上的变化。因此,T1 mapping可以作为一种无创和定量的方法来确定生物组织特性,最初用于心肌疾病的研究,但最近也被用于肿瘤研究,包括脑、心脏、前列腺、肝和肾。然而,没有研究将T1 mapping应用于腮腺肿瘤的特征分析。因此,T1 mapping在区分腮腺肿瘤方面的价值尚不明确。
近日,发表在Eur J Radiol杂志的一项研究探讨了增强前和增强后的T1 mapping和RESOLVE-DWI区分良、恶性腮腺肿瘤的可行性,并根据T1、ADC值以及结合多参数进行系统分析。
本项研究共回顾性地招募了128名经组织病理学证实的腮腺肿瘤患者[86名良性肿瘤(BTs)和42名恶性肿瘤(MTs)]。BTs进一步分为多形性腺瘤(PAs,n = 57)和Warthin瘤(WTs,n = 15)。在注射造影剂前后进行MRI检查,测量腮腺肿瘤的纵向弛豫时间(T1)值(T1p和T1e,分别)和表观扩散系数(ADC)值。计算了T1(T1d)值的减少和T1减少的百分比(T1d%)。
BTs的T1d和ADC值大大高于MTs(所有P <.05)。区分腮腺BTs和MTs的T1d和ADC值的曲线下面积(AUC)分别为0.618和0.804(所有P <.05)。区分PAs和WTs的T1p、T1d、T1d%和ADC值的AUC分别为0.926、0.945、0.925和0.996(所有P>.05)。与T1p、T1d和T1d%相比,ADC和T1d%+ADC值在区分PAs和MTs方面表现更好(AUC值:0.902、0.909、0.660、0.726和0.736)。T1p、T1d、T1d%和T1d%+T1p值在区分WTs和MTs方面都有很高的诊断价值(AUC值:分别为0.865、0.890、0.852和0.897,P均>.05)。
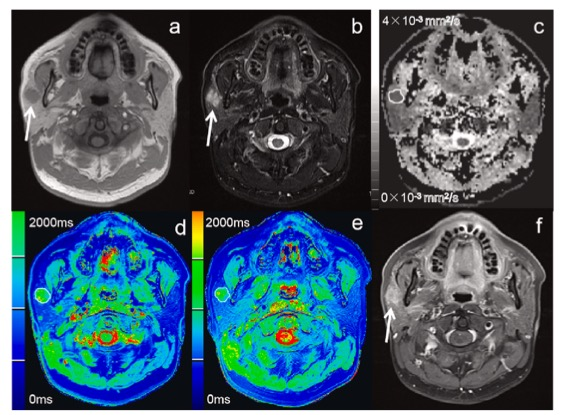
图 一名44岁男性患者的右侧多形性腺瘤。(a) T1WI显示,肿瘤呈低信号,边界不清,形状不规则(白色箭头)。(b) FS-DIXON T2WI显示,肿瘤呈高信号(白色箭头)。(c) ADC测量表明,肿瘤的ADC值为0.80 × 10- 3 mm2/s。(d) Gd-DTPA给药前的T1图显示肿瘤的T1p值为1854.99ms。(e) Gd-DTPA给药后的T1图显示肿瘤的T1e值为976.94 ms。(f) FS-DIXON增强T1WI显示肿瘤有不均匀的中度强化(白色箭头)
本项研究表明,T1 mapping和RESOLVE-DWI可用于对腮腺肿瘤进行定量区分,并可相互补充,为临床的术前准确诊断提供了技术支持。
原文出处:
Baohong Wen,Zanxia Zhang,Kun Fu,et al.Value of pre-/post-contrast-enhanced T1 mapping and readout segmentation of long variable echo-train diffusion-weighted imaging in differentiating parotid gland tumors.DOI:10.1016/j.ejrad.2023.110748


