病理干货 | NTRK基因融合在实体瘤中的广谱性、突变率和诊断策略
时间:2023-12-11 10:36:57 热度:37.1℃ 作者:网络
神经营养酪氨酸受体激酶(NTRK)基因主要包括NTRK1、NTRK2和NTRK3,是编码原肌球蛋白受体激酶(TRK)家族的TRKA、TRKB和TRKC受体。NTRK基因融合是多种癌症的驱动因子,广泛存多种实体瘤中。目前临床上NTRK基因融合抑制剂疗效显著,在肿瘤治疗领域具有巨大的潜力。意大利基耶蒂佩斯卡拉大学Antonio Marchetti研究团队通过对不同实体瘤中NTRK基因融合的广谱性和突变率进行研究,提出了NTRK基因融合全面诊断筛查策略,以便在临床上快速筛查罕见突变。
01 NTRK基因重排在实体瘤中的广谱性
NTRK基因重排具有独特的双重分布模式:在部分罕见肿瘤中高频率出现,在常见的肿瘤中出现频率极低。NTRK基因经常发生突变的罕见癌症包括儿童纤维肉瘤、先天性肠系膜瘤、分泌性乳腺癌和唾液腺瘤等(图1)。
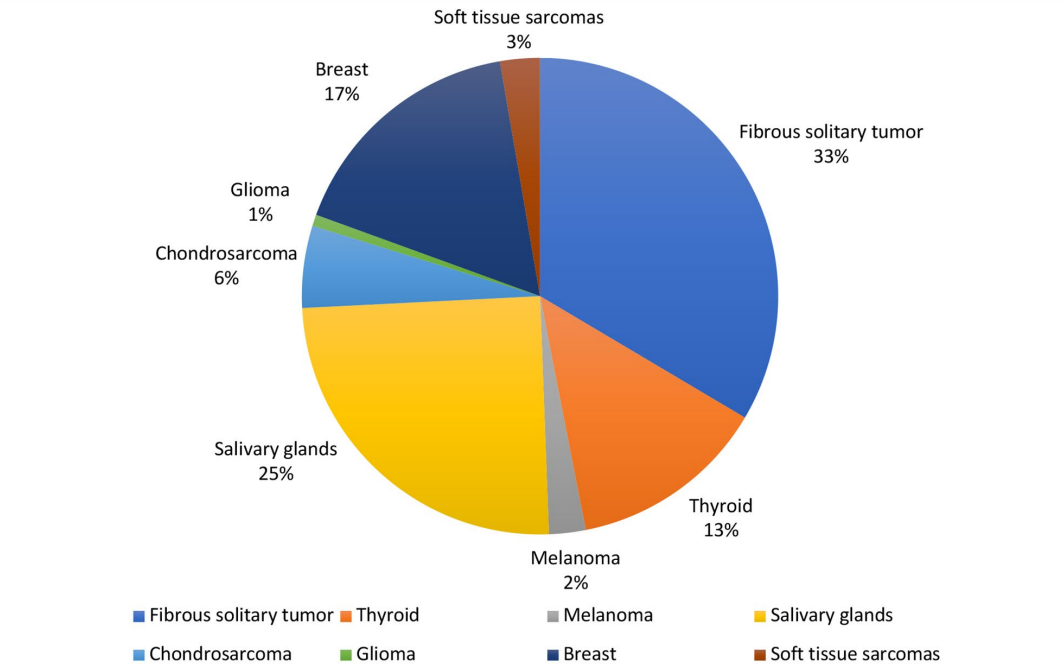
图 1. NTRK 基因融合在罕⻅肿瘤中的突变频率
(数据来⾃Westphalen 等⼈)
02 NTRK基因重排在实体瘤中的突变频率
NTRK基因的在常见癌症中突变频率较低。纪念斯隆凯特琳癌症中心用大规模回顾性分析对基因组筛查,目的是了解NTRK融合在不同实体瘤中突变频率、分布和基因组背景。
2019年,Solomon 等人研究了33997例患者,共38095个样本,发现NTRK基因融合87例(0.25%)。在常见癌症中,唾液腺肿瘤的NTRK患病率为5.08%,浸润性乳腺癌为0.13%。研究发现,NTRK 基因融合与常见的驱动突变如 KRAS、BRAF、NRAS和EGFR不共存。
2020年Rosen 等人在26,000例病例中发现76个 NTRK融合,NTRK基因重排的总体突变率为0.28%。此外,NTRK突变的肿瘤显示出较低的肿瘤突变负荷 (TMB),但具有微卫星不稳定性 (MSI-H) 的结直肠癌除外。Gatalica 等人的研究也获得了类似的结果,研究团队用NGS检测了11,502个组织样本,NTRK融合阳性31例(占整个队列的 0.27%)。研究的结果还显示,最常见的融合类型是 ETV6/NTRK3 和 TPM3/NTRK1 。
2021 年,Westphalen 等人扩大了研究队列,以限制选择偏差,以获得临床实践中尽可能有意义的结果。这是关于实体瘤中NTRK1、NTRK2和NTRK3重排的最大研究。特别是Westphalen 等人使用来自 FoundationCORE®(Foundation Medicine Inc,Cambridge,MA,USA)的数据库收集了295,676 名不同肿瘤的成人和儿童患者的数据。该研究评估了NTRK基因重排的普遍性、其他致癌驱动基因共存情况以及与不同融合伙伴的关联,在 45种不同肿瘤中NTRK 融合阳性有889例 (0.3%) 。在成年人群(> 18岁)中,融合阳性肿瘤的患病率为 0.28%;在儿科队列中,在 5 岁以下儿童基因融合阳性率为1.34% ,峰值为2.28%。在成人中,NTRK融合发生率最高的癌症是唾液腺癌(2.43%)、软组织肉瘤(1.27%)和甲状腺肿瘤(1.25%)(图 2)。NSCLC 是最常见的 NTRK 融合成人癌症类型(136例,其中95例腺癌),其次是乳腺癌(117例,其中未特指的71例癌和浸润性导管癌42例),软组织肉瘤(79例,包括37未特指的肉瘤和13例脂肪肉瘤)和结直肠癌(77例,包括73例结肠腺癌)(图 3)。
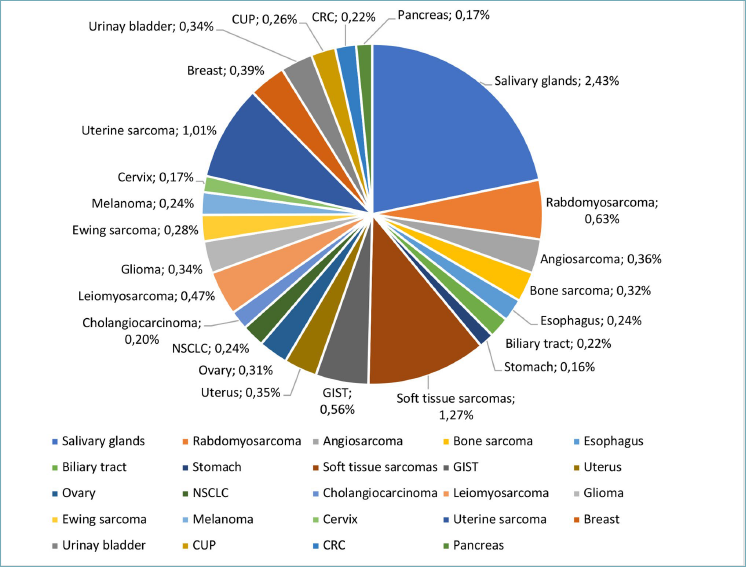
图 2. NTRK 基因融合在成人肿瘤中的患病率
(数据来自Westphalen等人、Rosen等人、Solomon等人)
CRC、结肠直肠癌;CUP,原发性不明癌症;GIST,胃肠道间质瘤;NSCLC,非小细胞肺癌。
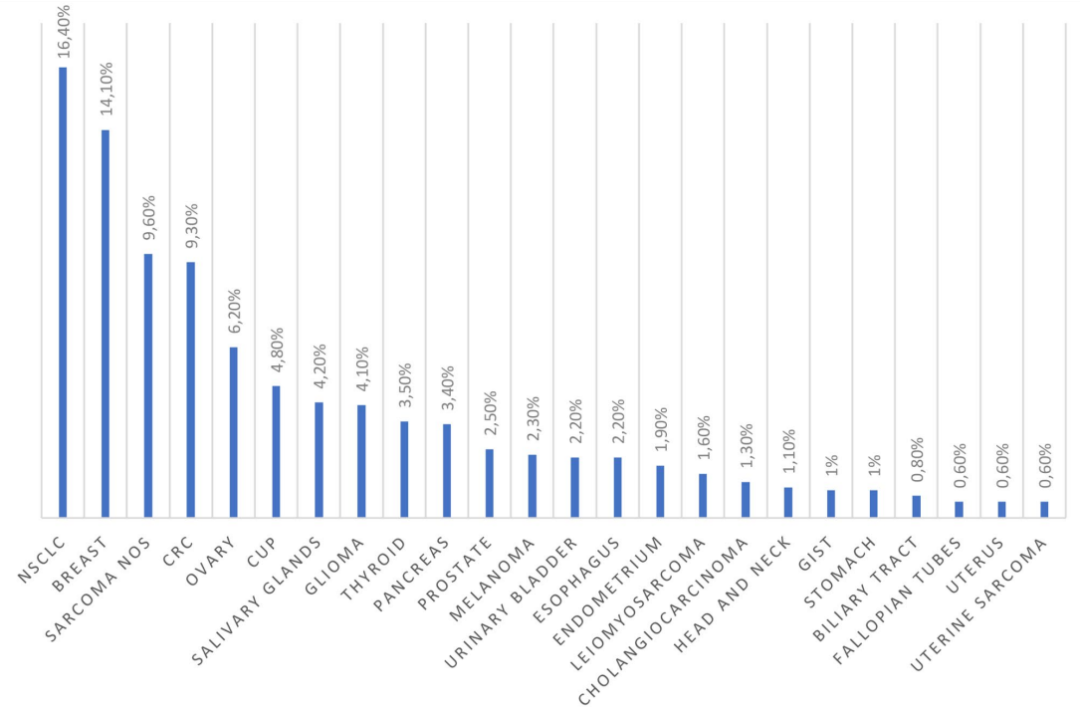
图 3. NTRK 基因融合阳性在不同肿瘤类型成年人群中的患病率(数据来⾃ Westphalen 等⼈)。
CRC:结直肠癌;CUP:原发性不明癌症;GIST:胃肠道间质瘤;NSCLC:⾮⼩细胞肺癌
NTRK基因融合的可能伙伴有88 种,其中58种(65.9%) 从未被描述过。ETV6-NTRK3 是成人(78/295例,26.4%)和儿童(17/52例,32.7%)中最常见的基因融合,其次是TPM3-NTRK1 (21.5%) 和 LMNA-NTRK1 (9.5%)(图 4)。
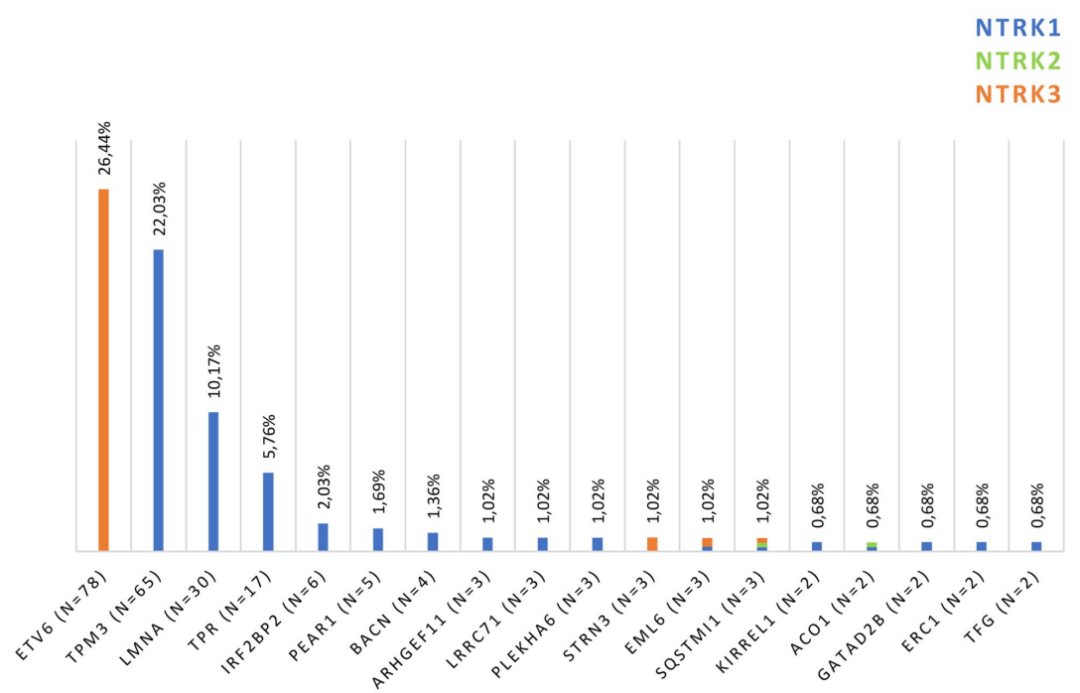
图 4.按频率划分的成年人群中 NTRK 基因的主要融合伙伴 (根据 Westphalen 等人修改)。
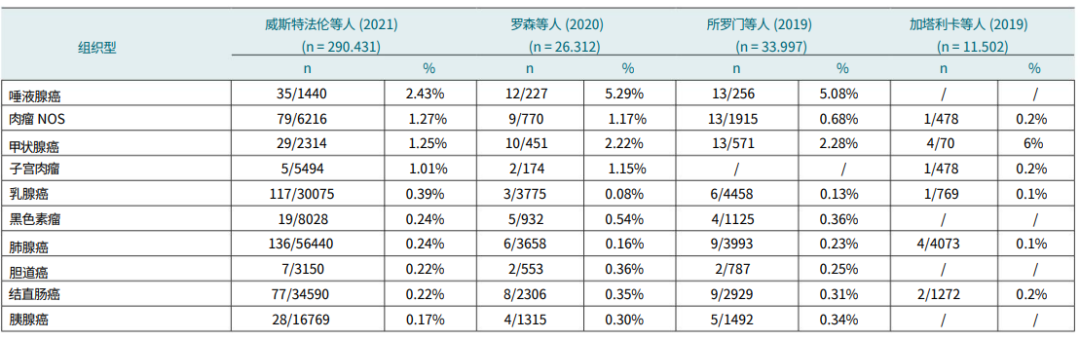
NTRK 突变很少与 KRAS、APC、TP53 和 PIK3CA 等突变共存,并且与常见的肿瘤驱动因子(EGFR、ERBB2、RET、ALK、MET)互斥,尤其是在乳腺、结肠和肺肿瘤中。另一个值得注意的方面是与肿瘤突变负荷的关系,这在有和没有NTRK融合的肿瘤中是相似的,尤其是在NSCLC中。相反,这种特征在NTRK突变的结直肠癌中增加。Westphalen 等人将他们的结果与I期和II期临床试验(ALKA-372-001、STARTRK-1、STARTRK-2)中获得的结果进行比较,以验证entrectinib在NTR 融合阳性的晚期实体瘤或转移性癌症患者中的安全性和有效性。该分析的目的是确认在一般人群中获得的结果的有效性。将FoundationCORE数据库中的成年患者与三项临床试验中的11 个NTRK融合阳性患者组进行了比较,强调了两个队列中肉瘤、非小细胞肺癌、胰腺癌、胆管癌和子宫内膜癌患者的频率相似。相反,频率在参与临床试验的患者队列中,分泌性乳腺癌的发病率较高,这很可能是由于筛查偏倚所致。在乳腺癌、结直肠癌和卵巢癌中表现出不同的趋势。在各种研究中,按性别和年龄的分布相似。表1报告了在不同研究中检测到的最常见实体瘤中NTRK基因融合的频率。
表1. NTRK基因融合在常见实体瘤中的阳性率。NOS,未另行说明
03 NTRK基因融合的检测技术
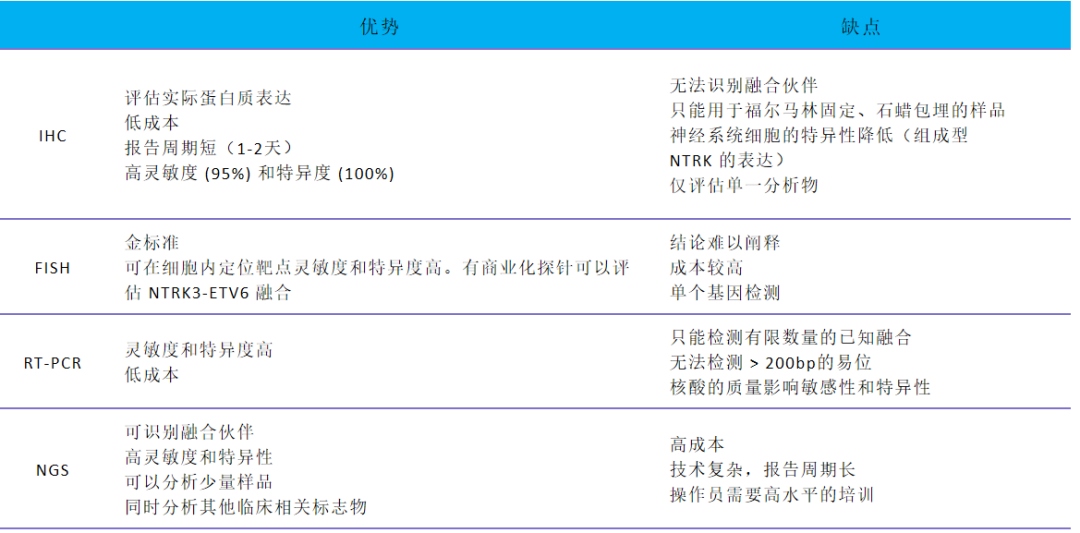
由于NTRK基因融合突变频率较低,检测的关键问题是如何以合适的方法学选择患者进行靶向治疗。目前,NTRK融合的检测方式包括免疫组化(IHC)、荧光原位杂交(FISH)、逆转录聚合酶链式反应(RT-PCR)和二代测序(NGS)等。各种检测技术的优缺点如表2所示。
表 2、各检测技术的优点和缺点
04 NTRK 基因融合诊断策略
考虑到NTRK基因融合突变频率低和⼴泛性,⾸先有必要评估上述方法的效率和成本。多项研究表明,pan-TRK IHC 是⼀种有效识别肿瘤的⽅法,可快速检测。在IHC蛋⽩质表达异常的情况下,建议通过NGS进一步筛选,以确认是否有可疑的基因改变。鉴于检测技术的特性以及它们在临床实践中的可用性以及成本和效率,提出了一种NTRK 基因融合诊断策略,将肿瘤细分为两组,每组采用不同的诊断方法:NTRK 基因融合发生率高的组和NTRK 基因融合率低的组(图5)。
NTRK 基因融合率高(> 50%)的肿瘤包括儿童纤维肉瘤、乳腺和唾液腺分泌癌以及先天性中胚层肾瘤。此类肿瘤应常规分析NTRK基因融合,通常使用 FISH和/或 NGS 进行,特别注意ETV6-NTRK3融合。应该强调的是,FISH 的阴性并不排除融合的存在,这就是为什么在这种情况下应考虑进行二级NGS检测的原因。
NTRK 基因融合率低(< 5%)的肿瘤包括其余的恶性肿瘤。在其中一些肿瘤中(如 NSCLC、黑色素瘤、结肠直肠癌、甲状腺癌等)NGS是常规检测项目,检测项目应包含NTRK 基因。另一方面,在尚未常规推荐多基因检测的肿瘤(例如胰腺癌)中,使用pan-TRK IHC可以识别(尽管特异性有限)适合进行 NGS 进一步诊断研究的患者。需要强调的是,鉴于TRK蛋白可能的组成型表达,必须特别注意评估这些肿瘤(如 GIST、肉瘤和神经内分泌肿瘤)中的免疫组织化学测试。
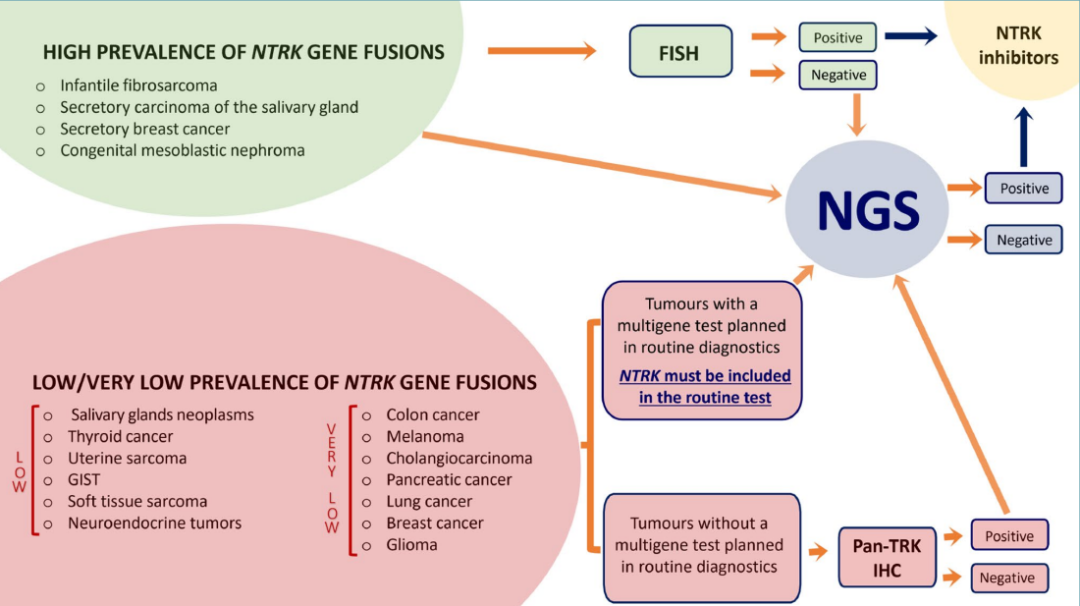
图 5.NTRK基因融合诊断策略,基于NTRK基因的突变率(⾼,> 50%;低,1-5%;⾮常低,< 1%)和常规分⼦检测项目。
早期发现罕见靶点和肿瘤诊断治疗的新诊断策略:
理论条件下,所有实体瘤都应该在早期检测罕见靶标,包括NTRK基因融合,这可以早期识别可能受益于靶向抗NTRK治疗的患者。然而,将检测扩展到所有侵入性实体瘤将需要高昂的成本和时间,是不切合实际的。即使是在诊断时对所有实体瘤进行简单的IHC筛查检测,目前在常规临床实践中也不可行。为了使IHC作为广泛肿瘤的筛查方法,Marchetti研究团队提出了一种有利于大规模应用 IHC pan-TRK 测试的方法,使用组织微阵列,这可以同时分析许多患者的肿瘤 ,已实施诊断工作流程以支持临床实践中的常规筛查(图 6)。这种新诊断方法的应用使得识别一系列罕见的分子靶点成为可能。该技术可以同时分析几十个样品,大大降低了成本和筛选所需的时间;阳性病例随后必须经过正交方法(NGS 或 FISH)进行确认。在这项试点研究的基础上,意大利病理解剖学和细胞诊断学会 (SIAPeC) 目前正在对约10,000 名患者进行多中心项目 (VITA SIAPeC) -IAP 项目)识别罕见的分子改变,包括 NTRK 基因的融合,主要关注年轻患者(< 50 岁)的肿瘤。
在常规诊断中筛查罕见基因突变用于广谱靶向治疗的病理工作流程
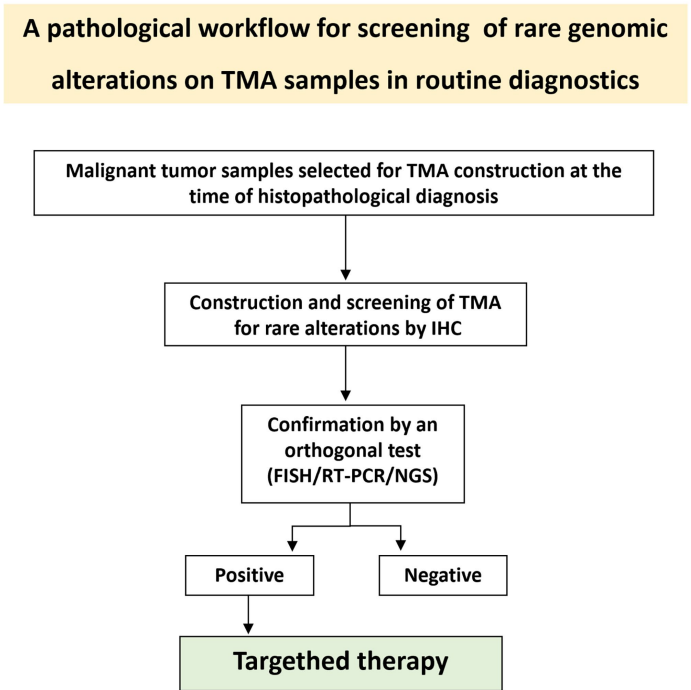
图 6.⽤于检测罕见⽣物标志物和选择患者进行广谱靶向治疗的简化诊断工作流程。(Marchetti 等⼈)
05 NTRK 基因融合抑制剂
拉罗替尼于2018年11月26日被FDA批准上市,用于成人和小儿具有神经营养受体酪氨酸激酶(NTRK)基因融合的实体瘤治疗,包括肺癌,黑色素瘤,结直肠癌,胃肠道间质瘤,乳腺癌,骨肉瘤,胆管癌,软组织肉瘤,唾液腺瘤,婴儿纤维肉瘤,甲状腺癌,原发性未知癌,先天性中胚层肾癌,阑尾癌和胰腺癌。在2022年4月13日获中国国家药监局(NMPA)的批准上市,用于治疗携带NTRK融合基因的实体瘤成人和儿童患者。在治疗效果方面,拉罗替尼针对17种实体瘤有效,有研究显示,拉罗替尼的客观缓解率75%,完全缓解率22%,部分缓解率为53%。拉罗替尼还专门在儿童肿瘤做了临床试验,在部分儿童癌症患者达到了93%的治疗应答。
Entrectinib(恩曲替尼)是一款靶向NTRK和ROS1融合的TKI类药物,于2019年8月获得美国食品药品监督管理局(FDA)加速批准上市,被授予突破性疗法(BTD)用于治疗携带NTRK基因融合的实体瘤患者,不限癌种。同年该药物也在日本获批上市,被授予先驱药物。次年在欧洲通过优先审评资格获得上市许可,成为又一款重磅“广谱”抗癌药。2022年7月29被CDE纳入优先审评,获NMPA批准上市。在治疗效果方面,罗氏曾公布entrectinib治疗晚期或转移性NTRK融合阳性实体瘤患者的I/II期临床结果。研究共入组54人,在10种NTRK融合阳性实体瘤患者中,客观缓解率(ORR)为57%,其中完全缓解率为7%,部分缓解率为50%,同时entrectinib耐受性良好、安全性可控。
参考文献
1、NTRK gene fusions in solid tumors: agnostic relevance, prevalence and diagnostic strategies,PATHOLOGICA 2022;114:199-216; DOI: 10.32074/1591-951X-787.
2、Russo A, Incorvaia L, Malapelle U, et al. The tumor-agnostic treatment for patients with solid tumors: a position paper on behalfof the AIOM- SIAPEC/IAP-SIBioC-SIF Italian Scientiffc Societies.Crit Rev Oncol Hematol 2021;165:103436. https://doi.org/10.1016/j.critrevonc.2021.103436.
3、Marchetti A, Di Lorito A, Felicioni L, et al. An innovative diagnosticstrategy for the detection of rare molecular targets to selectcancer patients for tumor-agnostic treatments. Oncotarget 2019;10:6957-6968. https://doi.org/10.18632/oncotarget.27343. PMID: 31857850; PMCID: PMC6916754.
4.Solomon JP, Linkov I, Rosado A, et al. NTRK fusion detection across multiple assays and 33,997 cases: diagnostic implications and pitfalls. Mod Pathol 2020;33:38-46. https://doi.org/10.1038/s41379-019-0324-7. Epub 2019 Aug 2. PMID: 31375766; PMCID: PMC7437403.
5.Rosen EY, Goldman DA, Hechtman JF, et al. TRK fusions are enrichedin cancers with uncommon histologies and the absence of canonical driver mutations. Clin Cancer Res 2020;26:1624-1632. https://doi.org/10.1158/1078-0432.CCR-19-3165. Epub 2019 Dec 23. PMID: 31871300; PMCID: PMC7124988.
6.Rosen EY, Goldman DA, Hechtman JF, et al. TRK fusions are enrichedin cancers with uncommon histologies and the absence of canonical driver mutations. Clin Cancer Res 2020;26:1624-1632. https://doi.org/10.1158/1078-0432.CCR-19-3165. Epub 2019 Dec 23. PMID: 31871300; PMCID: PMC7124988.
7.Gatalica Z, Xiu J, Swensen J, et al. Molecular characterization of cancers with NTRK gene fusions. Mod Pathol 2019;32:147-153. https://doi.org/10.1038/s41379-018-0118-3. Epub 2018 Aug 31. PMID: 30171197.
8.Westphalen CB, Krebs MG, Le Tourneau C, et al. Genomic contextof NTRK1/2/3 fusion-positive tumours from a large real-world population. NPJ Precis Oncol 2021;5:69. https://doi.org/10.1038/s41698-021-00206-y. PMID: 34285332; PMCID: PMC8292342.


