NEJM:BARD1突变的神经母细胞瘤患儿对PARP抑制剂具有良好响应
时间:2024-09-14 18:00:35 热度:37.1℃ 作者:网络
神经母细胞瘤(NB)是一种起源于未成熟神经细胞的儿童恶性肿瘤,常发生于5岁以下。最近有研究表明,在神经母细胞瘤患者中,BARD1基因携带了最显著富集的致病性或可能致病性的胚系变异。此外,研究发现神经母细胞瘤细胞系中的BARD1基因变异会导致同源重组修复缺陷,使这些细胞对PARP(聚腺苷二磷酸-核糖聚合酶)抑制剂非常敏感。
近日,来自圣裘德儿童研究医院(St. Jude Children's Research Hospital)的 Prof. Jinghui Zhang 和 Prof. Sara M. Federico 团队在 The New England Journal of Medicine 上发表题为 Response to PARP Inhibition in BARD1-Mutated Refractory Neuroblastoma 的研究论文,该论文报告了首例使用PARP抑制剂成功治疗高危难治性神经母细胞瘤的病例。该患者携带BARD1基因突变,通过PARP抑制剂与化疗药物联合治疗,利用了癌细胞的DNA损伤修复缺陷,基于合成致死原理,杀伤肿瘤。停止治疗32月后,该患者未检测到疾病复发,这为未来针对BARD1突变的神经母细胞瘤患者提供了合理的治疗依据。

该患者在22个月时被诊断为转移性高风险神经母细胞瘤,接受了以下治疗:化疗、手术、挽救治疗(包括环磷酰胺-拓扑替康和伊立替康-替莫唑胺联合化疗)、自体干细胞移植、放疗和异维A酸治疗。然而,在治疗结束时,患者的病情仍有进展,具体表现为骨髓中有30%的区域受到疾病侵袭。
之后,患者转移到该机构,接受了如下治疗。
疗程1:伊立替康、替莫唑胺和dinutuximab(一种针对GD2抗原的抗体)联合治疗。
疗程2:环磷酰胺、拓扑替康和dinutuximab联合治疗。
这两个疗程后,患者的病情达到稳定状态。
随后,对患者进行了全外显子测序,发现其BARD1基因存在致病性的胚系杂合性移码变异,但未发现其他驱动变异。因此,治疗方案调整为talazoparib(一种PARP抑制剂)和伊立替康联合用药,进行了3个疗程。在第5个疗程中,由于血小板减少,减少了伊立替康的剂量。在第6个疗程中,伊立替康停用,改为单药talazoparib治疗。在第26个疗程后,单药talazoparib治疗被停止。之后,患者已经在无治疗的情况下保持了32个月,并且没有出现临床疾病的证据。
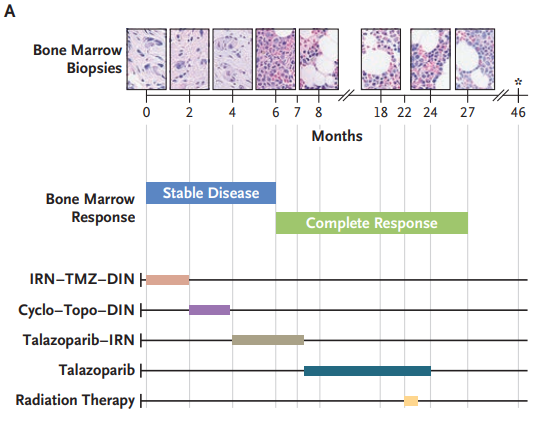
图1:治疗时间线和患者骨髓随时间的变化情况
Month 0 表示患者在该研究机构开始治疗神经母细胞瘤的时间点
RNA测序结果显示,患者肿瘤细胞BARD1的一个单等位基因发生了移码突变,并且在肿瘤组织中特异性表达。因此,患者对Talazopari的敏感性可能是由于肿瘤中BARD1基因的双等位基因缺失(图2)。对在Talazopari治疗前获取的连续骨髓样本进行了分析,证实了肿瘤细胞中BARD1蛋白的缺失(图3)。
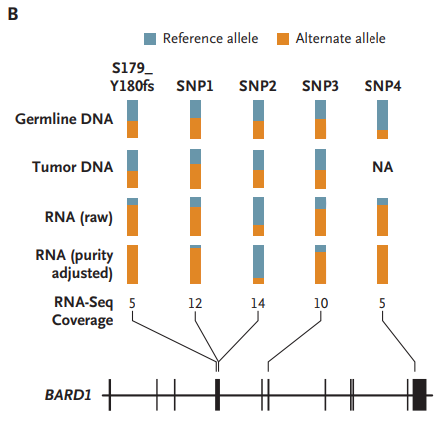
图2 患者肿瘤RNA测序中BARD1基因的等位基因特异性表达情况
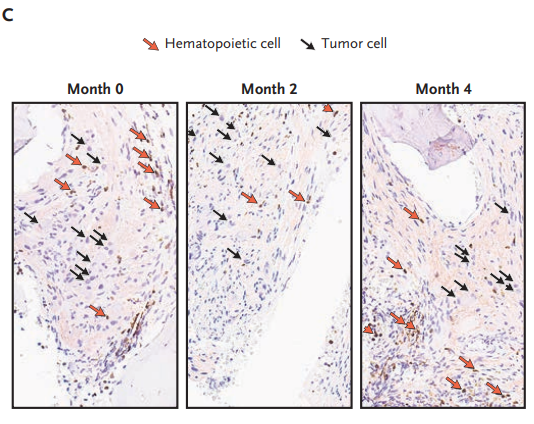
图3 第0个月、第2个月和第4个月时病人肿瘤细胞中BARD1蛋白的表达情况
黑色箭头标记了BARD1阴性的肿瘤细胞,这些细胞表现出神经节细胞的分化特征;
红色箭头标记了背景中的BARD1阳性造血细胞;其他的BARD1阴性细胞是肿瘤中的施旺细胞。
此外,使用基于儿童癌症数据训练的合成致死性网络模型对患者肿瘤进行分析。在分析的59个神经母细胞瘤样本中,患者肿瘤对PARP2的合成致死性评分最高(图4)。
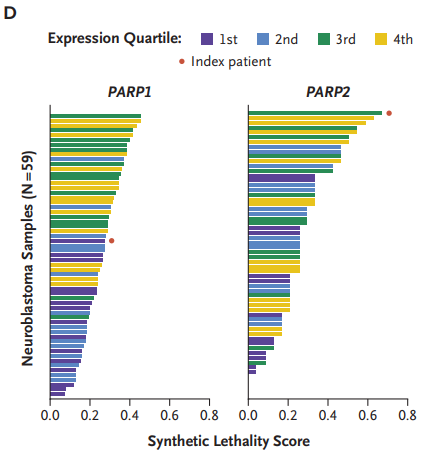
图4 了PARP1和PARP2的合成致死性评分
总之,患者对PARP2抑制剂表现出良好的响应,PARP2抑制剂治疗显示了良好的治疗效果。这可能是由于BARD1在肿瘤细胞中发生突变,PARP2抑制剂通过合成致死的机制导致肿瘤细胞死亡。本研究为BARD1突变的神经母细胞瘤患者提供了新的治疗思路,具有重要的临床价值。


