【期刊导读】导致慢乙肝患者肝硬化与肝癌发生发展的新机制探索
时间:2024-08-11 06:00:53 热度:37.1℃ 作者:网络
编者按
乙型肝炎病毒(HBV)感染是导致肝硬化和肝细胞癌(HCC)发展的重要因素,HBV的免疫逃逸阻碍了机体免疫系统对HBV的清除能力,在肝硬化的发展中起着关键作用。近年来,广大研究者致力于探索HBV免疫逃逸的机制,以期找到新的治疗靶点和策略。
NAC1(nucleus accumbens associated 1,伏隔核因子1)是CD4+ T细胞发育的抑制因子,已被发现在多种癌症中过表达。NAC1具有直接或间接调控LDHA(乳酸脱氢酶A)的能力,LDHA活性升高可促进癌细胞的增殖和侵袭性。近日,深圳市人民医院姚君教授和王立生教授团队发表在Oncogenesis上的一项研究揭示了NAC1通过激活LDHA转录表达,抑制CD8+ T细胞,从而诱导HBV免疫逃逸,最终导致肝硬化和HCC发生发展的作用机制。

研究总结
本研究旨在阐明NAC1在LDHA转录调控中的分子机制及其在HBV免疫逃逸中的作用,从而揭示其对肝硬化和HCC发展的贡献。研究者利用公共数据集,对HBV引起的肝硬化/HCC数据进行差异基因表达分析和加权基因共表达网络分析(WGCNA)。通过将差异表达基因与共表达模块交集,筛选出候选基因,利用TCGA数据库验证这些基因,并进行生存分析以确定影响HBV-HCC预后的关键基因。此外,研究者使用TIMER数据库分析了免疫细胞浸润数据,并分析其与已确定的关键基因的相关性,揭示潜在的免疫逃逸路径。在体外实验中,研究者探讨了NAC1和LDHA对免疫细胞凋亡和HBV免疫逃逸的影响。在体内实验中,研究者使用HBV诱导的肝硬化模型验证了以上发现。
本研究通过生物信息学分析揭示了受HBV感染影响的676个基因,其中475个基因在HBV-HCC中差异表达。NAC1被确定为其中的关键基因之一,可能通过调控LDHA的转录介导HBV的免疫逃逸。实验数据表明,NAC1在转录水平上激活LDHA,促进免疫细胞凋亡和HBV免疫逃逸。动物研究证实了这些发现,将NAC1介导的LDHA激活与肝硬化和HCC的发展联系起来。
综上所述,NAC1在HBV感染的肝细胞中高表达,可能通过激活LDHA表达、抑制CD8+ T细胞来驱动HBV的免疫逃逸,最终促进肝硬化和HCC的发展。
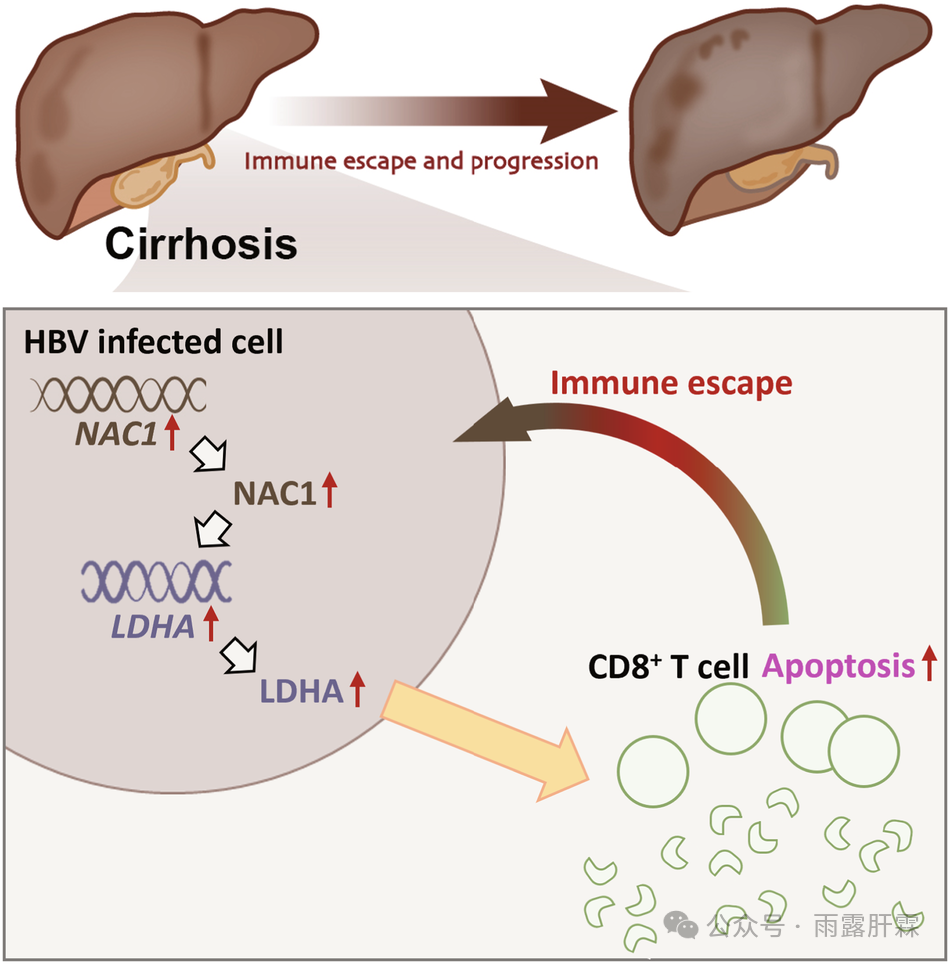
图1 NAC1介导的LDHA转录调控参与HBV免疫逃逸导致肝硬化和HCC发展的分子机制
NAC1通过转录激活LDHA表达,抑制CD8+T细胞,从而诱导HBV免疫逃逸,最终促进肝硬化和HCC的发生
肝霖君有话说
我国92.05%的肝癌由HBV感染引起。在慢乙肝的自然病程中,每年约有2-10%的患者进展为肝硬化,虽然在无肝硬化患者中肝癌的年发病率小于1%,但在肝硬化患者中年发病率升高至3-6%[2]。因此,探索HBV在诱发肝硬化、HCC中的病毒学和免疫学机制,将有助于慢乙肝患者实现长期的临床获益。
本研究通过数据集分析和细胞实验验证,揭示了NAC1通过激活LDHA转录促进HBV免疫逃逸的机制。在动物实验中,这一机制也得到了进一步确认,NAC1介导的LDHA激活与肝硬化和HCC的发展密切相关。尽管本研究揭示了NAC1和LDHA在HBV免疫逃逸中的重要作用,但仍需要通过临床实践验证这些发现,以确定其在慢乙肝患者中的适用性。确认NAC1和LDHA是否可以有效地作为治疗靶点,为HBV相关肝硬化和HCC提供更好的治疗选择,是未来研究的重要方向。希望通过进一步的研究,能为慢乙肝患者带来新的治疗希望,改善其长期预后和生活质量。
参考文献:
[1]Chen W, Guo L, Xu H, et al. NAC1 transcriptional activation of LDHA induces hepatitis B virus immune evasion leading to cirrhosis and hepatocellular carcinoma development[J]. Oncogenesis, 2024, 13(1): 15.
[2]中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2022年版)[J]. 中华传染病杂志,2023,41(1):3-28.



